systemic lupus erythematosus
SLEは、自己抗体、免疫複合体による細胞障害、組織障害が全身に及ぶ疾患である。生殖可能年齢の女性が約9割を占め、産科診療上決して稀な疾患ではない。SLEの罹患率は妊孕性のある女性の約500人に1人とされる。
素因をもったヒトに感染、ホルモン、紫外線、薬剤などの環境因子が加わって免疫異常が惹起されるものと考えられる。家族的発症も認められており、HLA-DR2やDR3との関係が報告されている。B細胞のpolyclonalな活性化とT細胞の制御機構の異常が起こり、自己抗体産生にいたる。組織障害性T細胞と産生された自己抗体は免疫複合体を形成し組織障害を起こし、種々の臓器症状を呈する。
診断は妊婦であっても非妊娠時と同様に診断基準に従って診断する。
******
【SLE の診断基準】
(アメリカリウマチ協会、1997 年改訂)
1.頬部紅斑:頬骨隆起部上の紅斑
2.円板状紅斑(ディスコイド疹)
3.光線過敏症:患者病歴または医師の観察による
4.口腔内潰瘍:医師の観察によるもので通常無痛性
5.関節炎:二つ以上の末梢関節の非びらん性関節炎
6.漿膜炎
a)胸膜炎:疼痛、摩擦音、胸水
b)心膜炎:心電図、摩擦音、心膜液
7.腎障害
a)0.5g/日以上または3 +以上の持続性蛋白尿
b)細胞性円柱:赤血球、顆粒、尿細管性円柱
8.神経障害
a)けいれん
b)精神障害
9.血液学的異常
a)溶血性貧血
b)白血球減少症:4,000/μL未満が2 回以上
c)リンパ球減少症:1,500/μL未満が2 回以上
d)血小板減少症:100,000/μL未満
10.免疫学的異常
a)抗DNA抗体:native DNAに対する抗体の異常高値
b)抗Sm抗体の存在
c) 抗リン脂質抗体:抗カルジオリピン抗体、ループスアンチコアグラント陽性、梅毒血清反応偽陽性
11.抗核抗体の検出
観察期間中、経時的あるいは同時に11 項目中4 項目以上存在すればSLE と分類する。
******
【SLE活動性判定基準】
(厚生省自己免疫疾患調査研究班、1985 年)
1. 発熱
2. 関節痛
3. 紅斑(顔面以外も含む)
4. 口腔潰瘍または大量脱毛
5. 血沈亢進(30mm/時以上)
6. 低補体血症(CH50:20U/mL以下、あるいはC3:60mg/dL以下)
7. 白血球減少症(4000/μL以下)
8. 低アルブミン血症(3.5g/dL以下)
9. LE細胞またはLEテスト陽性
上記9項目中3項目以上陽性を活動性と判定する。
(感度:95.7%、特異性:94.0%)
******
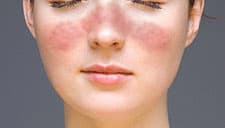
顔面(頬部)紅斑

円板状皮疹(ディスコイド疹)

口腔潰瘍
【妊娠がSLEに与える影響】
妊娠中一般的には妊娠14週頃までは増悪し、その後は分娩までは軽快し、分娩後に再度増悪する。(中絶後は分娩後と同様に増悪する。)
【SLEが妊娠・胎児に与える影響】
妊孕率:低下
流産・早産・死産:増加
妊娠高血圧症候群(PIH):増加
胎児発育不全(FGR):増加
胎児機能不全(NRFS):増加
母体死亡:増加
【SLE患者の妊娠許可の条件】
・ 免疫抑制剤の併用がなく、プレドニゾロン10mg/日以下で6カ月以上寛解状態にある
・ SLEによる重篤な臓器障害がない
・ ステロイドによる重篤な副作用の既往がない
・ 妊娠・出産・育児に伴う精神的肉体的負担の増大と危険性を十分理解できる
・ 抗リン脂質抗体、SS-A抗体の有無を検査
※ 従来は妊娠・出産はSLEの増悪因子と考えられて、避けることが望ましいと考えられていたが、最近は早期に診断される軽症例や長期寛解例で妊娠出産を希望する例が多くなってきた。一定の基準を設けて妊娠を許可する傾向にある。
【児に対する影響】
a)新生児ループス(neonatal lupus erythematosus: NLE)
・ ループス様皮疹、白血球減少症、血小板減少症などのSLE様の症状がみられる。症状の多くは一過性である。(先天性房室ブロックは非可逆的である。)
・ NLEは、母体血中からの抗SSA-IgG抗体、抗SSB-IgG抗体の移行と関係がある。母体からの移行抗体が消失する生後6カ月頃から症状は徐々に改善する。
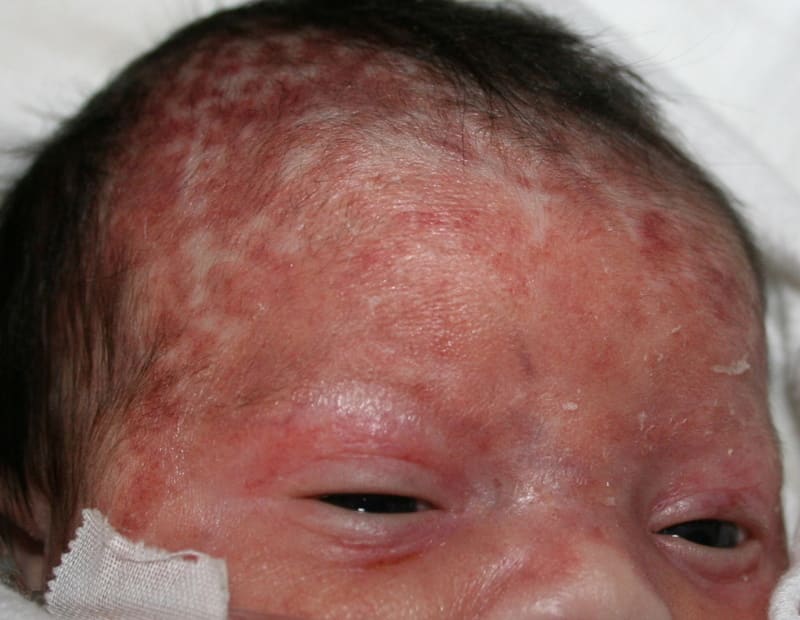
新生児ループス(NLE)
b)先天性房室ブロック
・ 心房結節、His束などに広範な心筋炎や線維化を生じる結果、房室ブロックを生じる。先天性房室ブロックのほとんどはSSA抗体、SSB抗体を有する母親から生まれるが、頻度は3%以下である。
・ 先天性房室ブロックは出生前に診断可能である。CTGで60bpm以下の除脈で基線細変動がみられない。
・ 先天性房室ブロックの児を妊娠した母親の多くは、妊娠中はSLEの症状は存在しなくてもその30~60%は、将来、自己免疫性の血管障害を呈するとされている。(次回妊娠もハイリスクとして扱う)
【妊娠前に注意すること】
・ 妊娠許可条件を満たしてから、(内科・産科主治医とよく相談して)計画的な妊娠をする。
・ 患者および産科医の認知事項:
①SLEの家族発症例あり、子どもがSLE になるリスクが高い。
②流・早産の頻度が高い(とくに抗リン脂質抗体症候群合併例)。
③腎炎悪化の可能性-ステロイドの増量の可能性がある。
④SS-A抗体、SS-B抗体陽性母体の4~25%に新生児ループスを認める(ループス様皮疹、先天性房室ブロック、血液検査異常〔白血球減少、血小板減少〕)。
【SLEが悪化した場合の対応】
・ 正常妊娠にみられる諸症状とSLE の症状が類似しているため、鑑別が難しい(全身倦怠感・手足の浮腫・腰痛などの関節痛・息切れ・手のしびれ・皮膚の変化)。
・ SLEの急性増悪を早期に発見:活動性の判定基準項目に注意をはらう。自己抗体の増加(抗2本鎖DNA抗体,抗Sm抗体など)、補体低下(C3,C4,CH50)、汎血球減少、発熱などを指標とする。とくに補体価の低下は重要な指標である。
・ 妊娠高血圧症候群、腎障害の発症予防に努め、増悪に注意する。
・ 胎児発育、妊娠22週以降胎児well-being のチェック。娩出時期を考慮する(胎児・新生児では流・死産、FGR、新生児死亡率が抗リン脂質抗体陽性例ではとくに高い).
・ 抗SS-A 抗体陽性─胎児房室ブロックの有無のチェックする(SS-A/Ro抗体やSS-B/La抗体陽性の際は、胎児完全房室ブロックを発症することがある)

【治療】
・ ステロイドの維持量(プレドニゾロン10mg/日以下)を継続投与する。
・ 妊娠許可条件を満たさずに妊娠した場合やSLEが悪化した場合は、ステロイドの増量を行い妊娠を維持させる。プレドニゾロンの維持量が15mg/日を超える場合、流早産や前期破水の率が高くなるため注意を要する。
・ 抗リン脂質抗体が陽性の場合は、抗凝固療法を行う。
【妊娠・分娩時の管理と治療】
一般的注意事項
安静を保ち、過労を避ける。
日光、寒冷、ストレスなどの増悪因子に注意する。
良好な病態とは、
ステロイドの維持量がプレドニゾロンとして、15mg/日以下。
腎機能が良好なもの(クレアチニンクリアランス70mL/分以上)。
抗DNA抗体陰性─とくにループス腎炎の病状に相関。

・ 厳重な管理を要する状態
抗リン脂質抗体陽性例(ステロイド・アスピリン療法、へパリン皮下注、血漿交換療法)
血清補体価(CH50、C3)の急激な低下や低値の持続例
抗DNA抗体陽性例
・ 寛解と再燃を繰り返すため、妊娠がSLEに与える影響は、妊娠前のSLEの活動性の程度により異なる。
・ 妊娠中一般的には妊娠14週頃までは増悪し、その後は分娩までは軽快し、分娩後に再度増悪する。
・ 妊娠初期から高次医療施設への紹介が望ましい。
・ 妊娠の有無で、基本的治療は変化しない。SLEの活動性により、ステロイド量を決定する。
・ ステロイド使用、子宮頸管炎、絨毛膜羊膜炎などの感染に注意し、早産に留意する。
・ SLEは出産後にしばしば増悪する。産褥期にも慎重な管理が必要である。
【予後に関わる合併症】
・ 流・死産、早産などの周産期異常は、健常妊娠の約2倍である。
・ SLE合併の妊娠母体の約40%にSS-A抗体、SS-B抗体を認める。
・ SS-A抗体、SS-B抗体陽性母体の4~25%に新生児ループスを認める(ループス様皮疹、先天性房室ブロック、血液検査異常〔白血球減少、血小板減少〕)。
・ 妊娠による腎炎の悪化に注意する。
・ 出産後の育児ストレスはSLE の悪化をまねくことがあるので、家族の協力が必要である。
【分娩方法】
・ 経腟分娩を原則とする。
・ 実際には合併症のため帝王切開の頻度が高い。
【検査】
・ 血清補体価(CH50):最悪期には低値を示す
・ 腎機能検査:Ccrなど。妊娠継続の可否を決定する
・ 赤血球数:減少、白血球数:減少、リンパ球数:減少、血小板数:減少
・ 抗SS-A抗体価:高値の場合、胎児心機能の精査が必要
【次回妊娠へのアドバイス】
・ 寛解と再燃を繰り返すことが多い
・ 入院は短期間ではすまないことが多い
・ 非妊娠時も経過観察が重要である
****** 問題
全身性エリテマトーデス(SLE)合併妊娠で正しいのはどれか。1つ選べ。
a 妊娠終了後にSLEが自然寛解することが多い。
b 血中補体の測定はSLEの活動性の指標となる。
c 妊娠中は副腎皮質ホルモン剤の投与量を減量する。
d 抗SS-A抗体、抗SS-B抗体陽性例では胎児の先天性心室性期外収縮を発症する。
e 胎児発育不全を合併しない。
------
正解:b
****** 問題
全身性エリテマトーデス(SLE)合併妊娠で正しいのはどれか。1つ選べ。
a 妊娠が成立した場合、副腎皮質ホルモン服用を中止する。
b 抗SS-A抗体は胎児心室性期外収縮の原因となる。
c 胎児発育不全(FGR)を生じやすい。
d SLEの増悪により血清補体価は上昇する。
e 妊娠終了とともにSLEが軽快する。
------
正解:c















