congenital esophageal atresia
● 概念
胎生期に、前腸に由来する気管原基と食道原基の分離障害(正常では胎生5~6週ころに分離する)により起こる。
● 病型分類(Gross分類)
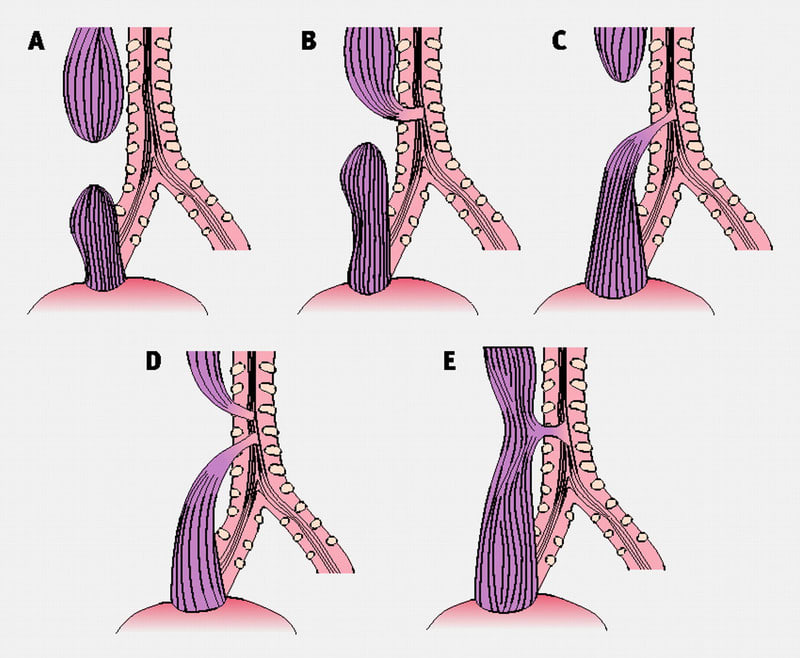
気管食道瘻 tracheo-esophageal fistula(TEF)
A型:上部・下部食道が盲端
B型:上部食道が気管と交通(TEF)、下部食道は盲端
C型:上部食道が盲端、下部食道はTEF
D型:上部・下部食道ともTEF
E型:TEFのみで食道閉鎖はない
C型:85~90%
A型:約10%
● 疫学
・ 出生3000~4000に1人の頻度である。
・ 明瞭な性差はない。(男女比ではやや男児に多い)
・ 約30%は低出生体重児。
・ 遺伝的背景はない。
● 症状
出生直後より口腔内に泡沫状貯留物があり、哺乳時の嘔吐やチアノーゼ、呼吸困難の出現に加え、胎児エコーにて羊水過多の存在があった場合には、まず本症が疑われる。
● 合併(約30%に奇形が合併)
・ 先天性心疾患
・ 消化管奇形: 十二指腸閉鎖症、鎖肛。
・ 泌尿器奇形
・ 脳・脊椎奇形
・ 染色体異常: 18トリソミーや13トリソミーの合併がみられる。
VACTERL連合(VACTERL症候群):
VACTERL連合は、脊椎の異常(V)、鎖肛(A)、心臓の異常(C)、気管食道瘻(TE)、橈骨異形成(R)、四肢の異常(L)から成り、しばしば致命的となる。本症候群と診断するには、これらの異常のうち3つ以上が該当する必要がある。これらの異常に関連して、尿道下裂および腎の異常がみられる場合もある。腎の異常としては腎無発生(もっとも高頻度)、閉塞性病変、膀胱尿管逆流、嚢胞性腎疾患がある。正確な遺伝様式は不明である。
● 検査

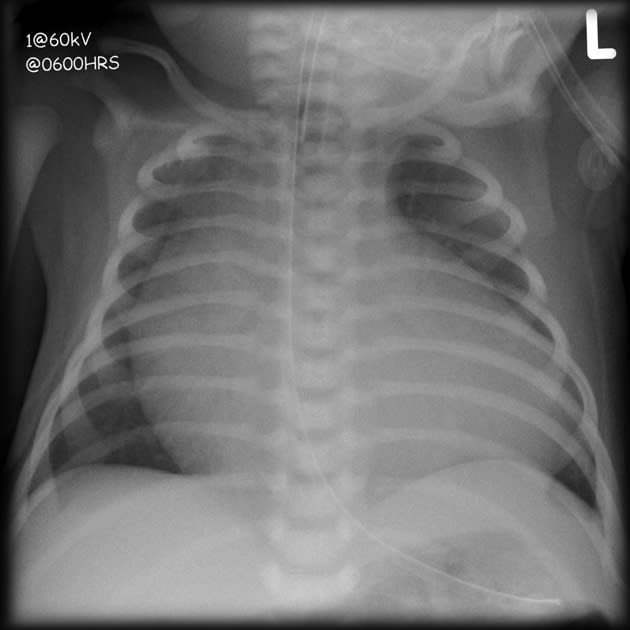
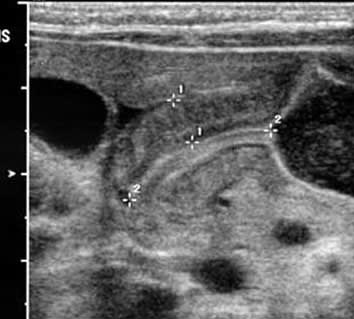
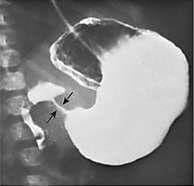
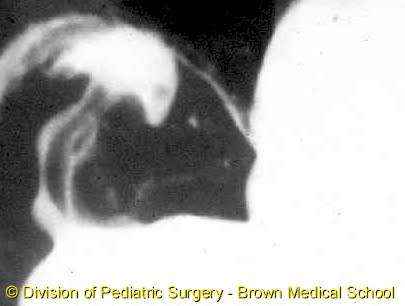
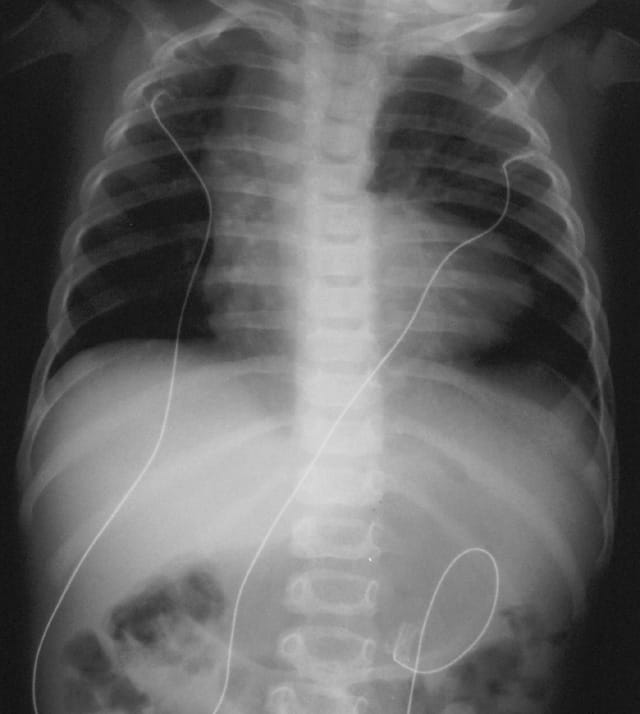
・ E型を除けば、胃に挿入しようとしたカテーテルが上部食道盲端で反転する所見(coil-up sign)が、単純X線像で認められる。このX線撮影時、造影剤の使用は禁忌である(上部食道と気管にTEFがあれば、造影剤の使用で致死的な呼吸器合併症を引き起こす)。
・ 胃内空気像(胃泡)を認めればC型、認めなければA型の可能性が大きい。
・ 胎児エコー: 羊水過多、胃泡を同定し難い(AおよびB型)。
● 治療
?C型の場合、上部・下部食道間の距離が短く、TEFから気管への胃液の流れ込みがあるので、直ちに根治手術をするのが原則である。TEFの切離と食道の淡々吻合が行われ、多くは一期的に可能である。
?A型の場合、上部・下部食道間の距離が長いlong-gap症例が多く、一期的な吻合が行えないため、まず胃瘻を造設し、上下食道の延長術を行い、乳児期以降に食道を吻合する多段階手術となることがある。
****** 参考となるサイト
日本小児外科学会のホームページ:先天性食道閉鎖症の解説
http://www.jsps.gr.jp/05_disease/gi/esph_atrs.html
****** 問題
出生直後から泡沫状の唾液排出と呼吸困難とをきたすのはどれか。
a. 食道憩室
b. 食道アカラシア
c. 先天性食道閉鎖症
d. 肥厚性幽門狭窄症
e. 先天性十二指腸閉鎖症
------
正解 c.
a. 食道憩室の主な症状は食物の逆流であり、出生直後にみられる疾患ではない。
b. 食道アカラシアは嚥下障害が主な症状であり、通常は20歳以降に発症する。
c. 泡沫状の唾液排出は食道閉鎖症のキーワード。気管との交通のために呼吸困難を呈する。
d. 肥厚性幽門狭窄症は生後2~4週に無胆汁性嘔吐で発症する。
e. 先天性十二指腸閉鎖症は、新生児期の胆汁性嘔吐が典型的な症状である。
****** 問題
出生直後の男児。母親が妊娠中に羊水過多を指摘されていた。出生直後から泡沫状唾液の流出とチアノーゼとがみられる。この疾患でみられるのはどれか。
a. 粘液便
b. 腹部陥凹
c. 左胸部のグル音
d. double bubble sign
e. coil-up徴候
------
正解 e.
a. 粘液便は腸重積に多い。新生児期にはまれ。
b. 腹部陥凹は、先天性食道閉鎖症のA型またはB型(気管と下部食道との交通のない型)でみられる。
c. 左胸部のグル音は、横隔膜ヘルニアや横隔膜弛緩症などでみられる。
d. double bubble signは、先天性十二指腸閉鎖症の典型的X線所見である。
e. coil-up徴候は、細いネラトンカテーテルを挿入したときに、食道の盲端でそれが反転する所見である。
****** 問題
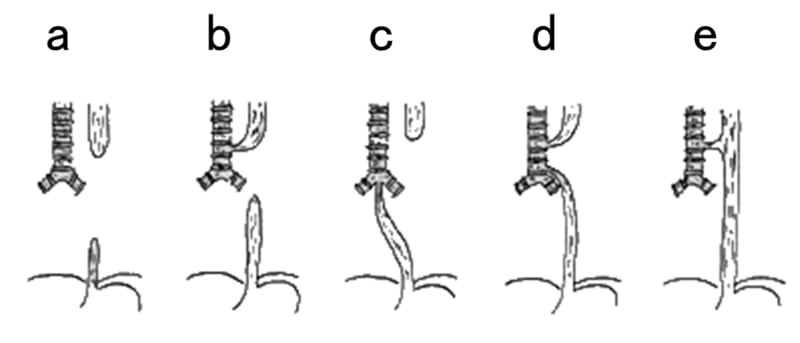
気管食道形成異常の病型を示す。頻度が最も高いのはどれか。
------
正解 c.
C型:85~90%、A型:約10%。
****** 問題
正しいのはどれか。3つ選べ。
a. 新生児期にも食道アカラシアがある。
b. 小児食道狭窄の原因は筋性線維性肥厚が多い。
c. 気管原基迷入は食道アカラシアの原因となる。
d. Gross B型食道閉鎖症は腹部膨満を伴う。
e. Gross D型食道閉鎖症は呼吸器系合併症を伴いやすい。
------
正解 a. b. e.
a. 食道アカラシアは、食道の筋層のAuerbach神経叢の変性が原因である。
b. 小児食道狭窄原因の比率は、気管原基迷入:筋線維性狭窄:膜様狭窄=10:10:1。狭窄の部位は下部食道に多い。
c. 気管原基迷入は、先天性食道狭窄症の原因となる。
d. Gross A・B型では腹部は陥凹している。C型では腹部膨満が起こる。
e. Gross D型は食道気管瘻を伴い唾液と胃液が気管に入り、呼吸器合併症を生じやすい。
****** 問題
正しいのはどれか。3つ選べ。
a. 嚢胞状リンパ管腫は頸部に好発する。
b. 先天性食道閉鎖症では下部食道が気管に交通する型が多い。
c. 正中頸嚢胞は胸腺の遺残から発生する。
d. 肥厚性幽門狭窄症では胆汁を混じた嘔吐が頻回に起こる。
e. 胎便イレウスでは汗のクロール濃度が高い。
------
正解 a. b. e.
a. 嚢胞状リンパ管腫はリンパ嚢の発生異常で、乳児期の頸部、顔面に後発する良性腫瘍である。
b. Gross C型が85~90%。下部食道と気管が交通し、胃腸管ガス像を認める。
c. 正中頸嚢胞は甲状舌管の遺残である。
d. 肥厚性幽門狭窄症では、噴水状の嘔吐をきたし、吐物には胆汁を混入しないのが特徴である。
e. 胎便イレウス(メコニウムイレウス)では、粘稠(ねんちゅう)な胎便のため、腸閉塞症を起こす。汗のNa、Cl濃度が60mEq/L以上であれば確定的である。