
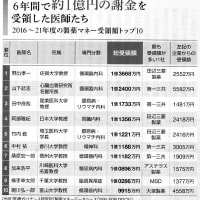
前回、イグザレルトの臨床研究ロケット・スタディーのワーファリン群のTTRが世界全体で62%、日本だけで67%であり、ワーファリン投与群というのはほとんどワーファリン非投与群に近い群であるということをお伝えしました。
引き続き、衝撃的な事実です。BMJという信頼性の高い医学雑誌からです。
Rivaroxaban; Can we trust the evidence? BMJ 2016:352 i575
イグザレルト、私たちはその臨床試験の結果を信じられるのか?
まず、抄録の全文を記載します。
Doctors and scientists are calling for an independent investigation into the key trial underpinning use of rivaroxaban to prevent ischaemic stroke in non-valvular atrial fibrillation after The BMJ found that a defective point of care device was used in the warfarin arm of the trial.
Doctors and scientists have also told The BMJ that the validity of the trial—called ROCKET-AF and published in the New England Journal of Medicine in 20111—is in question until such independent analysis is done.
The drug was manufactured by Bayer and marketed in the United States by Janssen, part of Johnson and Johnson, and the companies relied on a single trial–ROCKET-AF—to gain approval from the US and European regulators. The trial included over 14 000 patients and found that rivaroxaban was non-inferior to warfarin for preventing ischaemic stroke or systemic embolism. There was no significant difference between groups in the risk of major bleeding—although intracranial and fatal bleeding occurred less often in the rivaroxaban group.
But there are now concerns about these outcomes. In a letter submitted to the NEJM (as yet unpublished) and shown to The BMJ, former FDA cardiovascular and renal drug reviewer, Thomas Marcinicak, says: “The care for the warfarin control arm patients [in ROCKET-AF] appears to have been compromised.”
Earlier last year, The BMJ found that the point of care device used to measure international normalised ratio (INR) in patients taking warfarin in ROCKET-AF had been recalled in December 2014. An FDA class I recall notice (the most serious kind) said that certain INR devices could deliver results that were “clinically significantly lower” than a laboratory method.
太字の箇所を私なりに意訳してみると
「イグザレルトの臨床研究ロケットAF・スタディーで使用されたワーファリンのコントロールの程度を示すPT-INR値を測定する器械はアメリカ食品医薬品局の最も重大なclass Iのリコールをしていた。その器械は実際の臨床的PT-INR値より低い値が表示されてしまい、医者の実際の診療は、患者が出血しやすい状態でコントロールされていた。」
すごい事実ですね。バイエルの社員から正直にこんな情報聴いたことないですよ。
心房細動に対する新しい抗凝固療薬の臨床試験のワーファリン群の脳出血が多すぎる件シリーズを書いていますが、まだその事実を示した論文をご紹介できていない状況です。その前に予習する事項が多いのでご了承下さい。
情報の続きはまだまだありますので、次回以降もどんどんお伝えします。
↓なるほどなぁ~と思われた方!ここをポチッ、応援よろしくお願いいたします。
「ブログランキング」
引き続き、衝撃的な事実です。BMJという信頼性の高い医学雑誌からです。
Rivaroxaban; Can we trust the evidence? BMJ 2016:352 i575
イグザレルト、私たちはその臨床試験の結果を信じられるのか?
まず、抄録の全文を記載します。
Doctors and scientists are calling for an independent investigation into the key trial underpinning use of rivaroxaban to prevent ischaemic stroke in non-valvular atrial fibrillation after The BMJ found that a defective point of care device was used in the warfarin arm of the trial.
Doctors and scientists have also told The BMJ that the validity of the trial—called ROCKET-AF and published in the New England Journal of Medicine in 20111—is in question until such independent analysis is done.
The drug was manufactured by Bayer and marketed in the United States by Janssen, part of Johnson and Johnson, and the companies relied on a single trial–ROCKET-AF—to gain approval from the US and European regulators. The trial included over 14 000 patients and found that rivaroxaban was non-inferior to warfarin for preventing ischaemic stroke or systemic embolism. There was no significant difference between groups in the risk of major bleeding—although intracranial and fatal bleeding occurred less often in the rivaroxaban group.
But there are now concerns about these outcomes. In a letter submitted to the NEJM (as yet unpublished) and shown to The BMJ, former FDA cardiovascular and renal drug reviewer, Thomas Marcinicak, says: “The care for the warfarin control arm patients [in ROCKET-AF] appears to have been compromised.”
Earlier last year, The BMJ found that the point of care device used to measure international normalised ratio (INR) in patients taking warfarin in ROCKET-AF had been recalled in December 2014. An FDA class I recall notice (the most serious kind) said that certain INR devices could deliver results that were “clinically significantly lower” than a laboratory method.
太字の箇所を私なりに意訳してみると
「イグザレルトの臨床研究ロケットAF・スタディーで使用されたワーファリンのコントロールの程度を示すPT-INR値を測定する器械はアメリカ食品医薬品局の最も重大なclass Iのリコールをしていた。その器械は実際の臨床的PT-INR値より低い値が表示されてしまい、医者の実際の診療は、患者が出血しやすい状態でコントロールされていた。」
すごい事実ですね。バイエルの社員から正直にこんな情報聴いたことないですよ。
心房細動に対する新しい抗凝固療薬の臨床試験のワーファリン群の脳出血が多すぎる件シリーズを書いていますが、まだその事実を示した論文をご紹介できていない状況です。その前に予習する事項が多いのでご了承下さい。
情報の続きはまだまだありますので、次回以降もどんどんお伝えします。
↓なるほどなぁ~と思われた方!ここをポチッ、応援よろしくお願いいたします。
「ブログランキング」





















※コメント投稿者のブログIDはブログ作成者のみに通知されます