全身性エリテマトーデスの臨床像: 早期発症から高齢発症まで
Best Pract Res Clin Rheumatol 2024.
doi: 10.1016/j.berh.2024.101938.
全身性エリテマトーデス(systemic lupus erythematosus: SLE)は、複雑な病態を呈する疾患である。SLE は臨床所見および血清学的所見によって特徴づけられる。これらは特異的ではあるが、半数以上の症例では分類基準を十分に満たしていない (つまり感度は高くない)。このような病態は不完全型 SLE (imcomplete SLE) と呼ばれ、確定的で分類可能な SLE と同様に診断が難しく、臨床症状の重症度に応じて治療する必要がある。
さらに、早期の SLE 診断と治療介入は、寛解率や障害の蓄積において、疾患の転帰に良い影響を与える。診断後は、ほとんどの患者で再発·寛解の経過をたどる。寛解期間とグルココルチコイドの累積投与量は予後を左右する最も重要な因子である。したがって、SLE の臨床パターンを早期に把握することは、疾患の経過に合わせた治療介入に役立つ。
高齢発症 SLE (late-onset SLE) はまれであるが、診断が遅れ、シェーグレン症候群などの併存疾患の発生率が高くなることが多い。本総説では、SLE の疾患経過に焦点を当て、早期診断のための実用的な戦略、SLE の臨床パターンの概要、発症年齢の違いによる SLE の臨床像の多様性について述べる。
1. はじめに
全身性エリテマトーデス(systemic lupus erythematosus: SLE)は、複雑な多臓器にわたる慢性自己免疫疾患であり、主に出産適齢期の女性が罹患する。
SLE はさまざまな血清学的異常と臨床症状の組み合わせによって特徴づけられる。疾患の特徴は、性別、年齢、発症からの経過時間などいくつかの因子に影響される。
SLE が確定診断される前には前臨床期および初期臨床病期が存在する。この病期を認識することで、臨床病期の初期にすでに起こり始めている臓器障害の発生を予防することを目的とした早期診断と治療介入を確実に行うことができる。
SLE の臨床経過は、しばしば予測不可能な疾患活動性の再燃、進行性の臓器障害の蓄積、健康関連 QOL の低下を伴う。したがって、SLE 患者を適切な時期に診断し、適切に管理するためには、疾患の経過と臨床パターンを理解することが最も重要である。
2. 前臨床期の全身性エリテマトーデス
SLE の発症機序に関する現在の見解は、遺伝的に感受性のある個体において、環境因子(例えば、感染症、薬剤、紫外線)が自然免疫および獲得免疫の活性化を引き起こし、病原性自己抗体の産生につながるというものである。
自然免疫系と獲得免疫系が関与する正のフィードバックループは、SLE の前臨床期で自己免疫反応を増幅させる 。その結果、自己抗体の特異性が増加し、前臨床期が長期化する。
抗核抗体(anti-nuclear antibody: ANA)は SLE の免疫学的特徴であり、通常、診断の何年も前に無症状のうちに認められる。現在、SLE の標準的な評価には組み込まれていないが、遺伝因子、トランスクリプトーム(I 型インターフェロンシグネチャー [type I interferon signature] など)、可溶性メディエーター(抗体や炎症性サイトカインなど)に基づくマルチパラメトリック予測モデルは、SLE を発症するリスクの高い被験者の同定に役立つ可能性がある。
type I interferon signature
https://ard.bmj.com/content/70/Suppl_2/A24.1
リスクの高い人の予防法としては、SLE 発症の引き金になる可能性があると主張されている環境的に修飾可能な危険因子を取り除くことが挙げられる(表 1)。
表 1. SLE 発症と関連する環境因子および生活習慣
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#tbl1
後に SLE を発症する ANA 陽性患者では、SLE 発症前に、抗 dsDNA 抗体や抗 Sm 抗体など、より特異的な自己抗体が高い頻度で陽性となる。Arbuckle らは、SLE 患者の血清から抗 Ro/SSA 抗体が SLE の臨床的発症の平均 3.0 年前、確定診断の最大 9.4 年前(平均 3.7 年前)に検出され、抗 dsDNA と抗 Sm はそれぞれ臨床的発症の 1.2 年前と 0.5 年前に検出されたと報告している。
ANA 陽性は、さまざまな全身性・臓器特異的自己免疫疾患、ウイルス感染症、ANA 陽性を誘発することが知られている薬剤(TNFα 阻害剤、イソニアジドなど)の服用者、健常人、特に SLE 患者の健常な親族でもみられるため、ANA 陽性のみの SLE 診断に対する信頼性は低い。
間接免疫蛍光法(indirect immunofluorescence: IIF)Hep-2 アッセイを用いると、健常人における低力価 ANA(40 倍)の有病率は最大 30%と推定されるが、高力価 ANA(160 倍)が存在する場合は 5%未満である 。13,080 人の SLE 患者を対象とする 64 件の研究をまとめた最近のメタ分析では、IIF-Hep2 を用いた ANA 力価の上昇により SLE 診断に対する感度が低下し、特異度が高くなることが確認された。したがって、ANA は SLE が疑われる集団を絞り込むための感度の高いスクリーニング検査として用いられ、特異的バイオマーカーとして機能する他の自己抗体と組み合わせる必要がある(表 2)。
表 2. SLE 診断のバイオマーカーの感度、特異度、的中率
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#tbl2
SLE の診断にはゴールドスタンダードはなく、診断には医師の専門的知識とバイオマーカーによる臨床的判断が必要である。自己抗体検査が導入されて以来、症状発現から診断までのタイムラグは徐々に短くなっている。
3. 不全型全身性エリテマトーデス
SLE の発症は多くの場合緩徐であり、分類可能な疾患は通常数年かけて発症する。発症時、最大 50%の患者では、臨床症状および血清学的症状が SLE の分類基準を満たすには不十分である 。
分類は診断とは異なり、分類基準は研究者が臨床研究のために統一された患者群を同定するための標準化された定義である。分類基準は伝統的に、すべての可能性のある患者を対象とするのではなく、科学的な目的のために均質なコホートを作成することを目的としている。一方、診断基準は疾患の異質性を認識し、可能な限り多くの患者を同定することを意図している。診断基準がないため、SLE の診断は訓練を受けた医師の判断に依存し、他の結合組織病(connective tissue disease: CTD)、感染症(例、パルボウイルス B19、エプスタインバールウイルス、リーシュマニア)、悪性腫瘍(例、リンパ腫)など、SLE を模倣する可能性のある疾患を除外する必要がある。しかし、感度と特異度をうまく組み合わせた一連の分類基準は、臨床医の診断プロセスを助ける枠組みとして役立つであろう(表 3)。
表 3. SLE の分類基準
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#tbl3
まだ分類できない SLE の臨床症状は、境界型 (borderline)、潜伏型 (latent)、中間型 (intermediate)、蓋然型 (probable)、潜在型 (potential)、可能型 (possible)、そして最も頻度の高い不全型 SLE(imcoplete SLE: iSLE)などいくつかの方法で定義されている。
iSLE という用語は、SLE に特異的な臨床症状や血清学的異常(例えば、蝶形紅斑 [malar rush]、溶血性貧血、抗 dsDNA 抗体、抗 Sm 抗体)を認めるが、分類には不十分な病態を示す。iSLE と分類可能な SLE の患者では、SLE のリスク遺伝子座の遺伝的負荷が同等であることから、遺伝的感受性が類似していることが示唆されるが、表現型の違いは遺伝子と環境の相互作用の影響を受けている可能性がある。
iSLE の定義は、特定の CTD の分類基準を満たすには不十分な血清学的・臨床的特徴を特徴とする未分化 CTD(undifferentiated CTD: UCTD)と一部重複することがある。Mosca らによると、UCTD には以下の 2 つのタイプがある。すなわち、a) 長期間(少なくとも 3 年間)安定した徴候と症状を示す安定型 UCTD と b) 20-60%の症例で SLE を含む明確な CTD に進展する進展型 UCTD である。iSLE に相当し、分類可能な SLE に進展する危険性のある UCTD を認識することは、治療やフォローアップに対して臨床的な意味をもつ。
iSLE 患者の約 10-50%が SLE に移行し、その多くは発症後 5 年以内である。また、iSLE 患者はふつう SLE 患者より診断時の年齢が高い 。最近のメタ分析により、分類可能な SLE への進展に関連する臨床症状や血清学的症状がさらに明確になった(表 4)。
表 4. UCTD から SLE への進展に関与する臨床所見および血清学的所見
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#tbl4
ヒドロキシクロロキン(hydroxychloroquine: HCQ)治療が iSLE から SLE への進行を遅らせ、診断時に存在する自己抗体のレパートリーや発現量を減少させるという後ろ向き観察研究が報告されている。無作為プラセボ対照二重盲検臨床試験 SMILE (Study of Anti-Malarials in Incomplete Lupus Erythematosus) から、より確実な新しいエビデンスが得られることが期待されている。SMILE 試験では、ANA(少なくとも 80 倍)および SLICC の分類基準を 1 つまたは 2 つ満たすものとして定義された iSLE 患者が登録され、HCQ が 24 ヵ月以内の SLE への進行を予防または遅延させるのに有効であるかどうかを評価することを目的としている。HCQ による治療に加えて、進行予防戦略には、生活習慣の改善、喫煙習慣や無防備な日光暴露などの修飾可能な環境的危険因子の除去(表 1)が含まれる。
分類基準では SLE と分類できないが、iSLE 患者は必ずしも軽症とは限らず、多くの場合、初期の本格的な SLE に罹患しており、それに応じた診断と治療が必要である。興味深いことに、UCTD または iSLE の患者を本格的な SLE とみなす一連の臨床的・血清学的特徴は、研究間で十分に一貫しており、腎病変、急性皮膚症状、血小板減少、自己免疫性溶血性貧血、痙攣、抗 dsDNA 抗体、抗 Sm 抗体、低補体血症などを認める。
さらに、国際的な多施設共同研究により、SLE を模倣する疾患と SLE を早期に鑑別するのに役立つ一連の臨床症状と血清学的異常が同定された。典型的な蝶形紅斑を伴う粘膜病変(OR 15.0;95%CI: 8.4-26.6)や腎病変による尿検査異常 (蛋白尿、血尿、膿尿、円柱など)(OR 17.0;95%CI: 4.1-70.4)に加え、漿膜炎 (serositis)(OR 6.6;95%CI: 3.5-12.3)、滑膜炎 (synovitis)(OR 3.8;95%CI: 2.6-5.4)、発熱(OR 3.3;95%CI: 2.1-5.1)が SLE 診断と統計学的に有意な関連を示した。一方、初期の SLE では、SLE 模倣者より少ない特徴として、レイノー現象、シッカ症状 (sicca symptoms, ドライアイや口腔粘膜乾燥、嚥下障害、疲労がみられた。
これらの結果は、ACR 1997 基準(特異度 93.4%、感度 82.8%)および SLICC 2012 基準(感度 96.7%、特異度 83.7%)と比較して、感度(96.1%)および特異度(93.4%)で最も高い組み合わせを達成した EULAR/ACR 2019 SLE 分類基準についての情報を提供した。EULAR/ACR 2019 SLE 分類基準の精度を評価した追加研究もいくつかあり、高い感度(87.3-97.4%)と高い特異度(87.8-97.3%)の両方が報告されている。早期SLE(診断が 12-36 ヵ月未満)のサブコホートでは、感度87.3-92.8%、特異度 87.8%と良好な ROC 特性が確認された。
注目すべきは、最近の単一施設の後ろ向き研究で、早期 SLE と診断された患者の 8.6-20.1%が、EULAR/ACR 2019、SLICC 2012、ACR 1997 の基準を個別に用いても正しく分類されないことが示唆されたことである。
4. 早期全身性エリテマトーデス
早期 SLE (early SLE) という用語は、SLE の前臨床·臨床的特徴を認めるものの、分類基準を満たさない対象者を表すために、iSLE の代替として使用されてきた。一方、早期 SLE という用語の意味は、分類とは無関係に、症状の発現に関して最近 SLE と診断された被験者を示すように変化している (図 1) 。このパラダイムシフトは、症状の早期発見とそれに続く早期の治療介入が、臓器障害の発生と進行を予防できるという認識の高まりによるものである。
とはいえ、症状の発現から SLE と診断されるまでの期間の中央値はまだ長すぎる(2 年以上)と報告されており、その主な原因は、最初に症状を医師に訴えてからリウマチ専門医が診断するまでの時間である。レッドフラッグの策定や紹介患者をスクリーニングするツールの導入など、臨床的に実行可能な取り組みがあれば、プライマリケア医や非リウマチ専門医からリウマチ専門医への紹介時間を短縮できる可能性がある(表 5)。
表 5. SLE の診断が遅れる理由とリウマチ科への紹介までの期間を短くするための対策
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#tbl5
例えば、SLE Risk Probability Index (SLERPI) は、診断のためのリスク予測を可能にする臨床医にやさしいアルゴリズムであり、明確な基準を満たさない初期の SLE 患者においても高い精度を示した。SLERPI はさまざまな環境下におけるさらなる検証を受ける必要はあるものの、非特異的な血清学的特徴(例えば、ANA 単独陽性)を示し、かつ疑わしい臨床症状(例えば、 蝶形紅斑や蛋白尿 >500 mg/24 時間)を認める場合、あるいは複数の臨床症状があるが免疫学的異常がない場合、さらには特異的自己抗体(抗 dsDNA 抗体、抗 Sm 抗体など)が陽性で単独の臨床症状(血小板減少症や自己免疫性溶血性貧血など)をともなう場合などにスクリーニングツールとして有用である可能性がある。
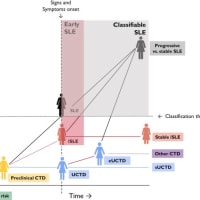
図 1. SLE の発症、臨床的発症、診断、分類のタイムライン
https://ars.els-cdn.com/content/image/1-s2.0-S1521694224000093-gr1.jpg
自己免疫に対する遺伝的感受性を有する健常人(緑色のシルエット)は、CTD を発症するリスクがあると考えられる。臨床症状が出現する前に、SLE に対する特異性が低い(ANA、抗Ro/SSA 抗体など)、または高い(抗 dsDNA 抗体、抗 Sm 抗体など)自己抗体が増加することを特徴とする、期間が変動し予測できない前臨床期(黄色のシルエット)が存在することがある。
明らかな臨床症状や徴候がある場合(縦の破線)、SLE に対する特異性が低く(例えば、レイノー現象、関節痛、シッカ症状)、定義された CTD に分類するには不十分であることがある。このような患者(青いシルエット)は UCTD と呼ばれ、長期に安定した状態(安定型 UCTD)か、定義された CTD に移行する可能性がある。
血清学的プロファイルと臨床症状が SLE を示唆する特異的なもの(例えば、蝶形紅斑、痙攣)であっても、有効な基準で分類するには不十分な場合は、不全型 SLE(赤いシルエット)と診断することができる。血清学的プロファイルと臨床症状が特異的で十分であれば、定義された SLE と診断・分類できる(黒いシルエット、分類閾値以上、濃いグレーのウィンドウ内)。不全型 SLE を含め、SLE の診断が、分類や重症度に関係なく、症状出現後短期間でなされた場合は、早期 SLE(ピンクウィンドウ)と考えられ、より良い転帰で病勢が安定する可能性が高い。
レセプトデータベースの分析によると、SLE 患者は症状発現から 6 ヵ月以内に診断された場合、診断が遅れた患者に比べて重症度が低く、フレア率や入院回数も少なかった。さらに、観察研究では、診断から 6 ヵ月以内に寛解またはループス低疾患活動性状態(lupus low disease activity state: LLDAS)を達成し、その後 12 ヵ月間維持されることが、新たに SLE と診断された患者における障害の発生を低く抑えることを独立して予測することが示された。
診断から 1 年後の SLE 患者の最大 22%が、SLICC/ACR 障害指標で評価された少なくとも 1 項目の障害を有している。さらに、診断後 1 年以内に早期の障害を有する患者は、障害の発生リスクが 2 倍であり、死亡率は障害のない患者の約 3 倍である。
寛解または低疾患活動状態を目標に治療し、バックグラウンド治療として HCQ を追加し、併存疾患に対処し、プレドニゾンの使用を 5 mg/日以下に抑えることで、疾患の早期から統合的なアプローチを実施することが、新たに SLE と診断された患者の早期障害発生を抑制するのに役立つと考えられる。
早期 SLE の定義は、症状発現からの経過時間に関して、6 ヵ月未満から 36 ヵ月未満までといくつか提案されているが、コンセンサスは得られていない。さらに、これらの期間のいずれかから治療を開始すれば、SLE の寛解を達成し、障害の発生を予防する可能性を高めるかどうかについては、十分に検討されていない。
5. 全身性エリテマトーデス発症後の臨床経過
5-1. SLE の臨床経過のパターン
診断後の SLE の臨床経過は、一般に、臨床的疾患活動性の亢進(再燃またはフレア)と寛解の時期が交互に繰り返されることを特徴とする。寛解の期間は患者によって大きく異なり、コンプライアンスなどいくつかの要因に左右される。
このよく知られた疾患活動性のパターンとは別に、ジョンズ・ホプキンス大学のループスコホートによる初期の研究では、「長い休止期」と「慢性的に活動的な」パターンも同定された。この報告は非受診患者(診断後経過観察していない)を対象としたもので、慢性活動性パターンが最も顕著で、累積患者年数(平均追跡期間 4.5 年)のほぼ 40%を占めていた。約 20 年後、少なくとも 1 年間の追跡調査が行われた全患者を対象とした同センターの研究では、慢性活動性パターンをとるのは 19%に過ぎないと結論づけられた 。再発寛解型が 50%と最も多いパターンであったが、31%は長い休止期経過をたどった。
これらの研究では、疾患活動性はPGA(Physician's Global Assessment)とメキシコ版 SLEDAI(M-SLEDAI、血清検査を除く)に基づいて定義され、再燃は M-SLEDAI のスコアが前回より上昇したものと定義された。トロントループスクリニックの 267 人の民族的に多様な初発患者(診断から初診までの期間は平均 3 ヵ月)を少なくとも 10 年間追跡調査した研究では、患者の約 70%が再発寛解パターンを示した 。長期にわたって寛解が続いている患者と活動性が持続している患者との間ベースライン時の人口統計学的特徴、臨床的所見、血清学的所見、治療内容について差がなかった。最初の 10 年間、これらの患者はほぼ半分の期間(平均 5.3 年)を寛解状態で過ごし、2-4 回の再燃を経験した。疾患活動性は SLEDAI-2K に基づいて定義され、寛解は臨床的 SLEDAI-2K = 0、活動性は SLEDAI-2K ≧ 1 と定義された。
267 人の患者の約 10%が長期寛解の経過をたどった。疾患活動性の初期段階(診断時)の後、これらの患者は診断から 2 年以内に臨床的寛解(SLEDAI-2K で定義)を達成し、罹病後10年間は再燃しなかった 。これらの患者のほとんど(74%)は、平均 18 年間の追跡期間中、再燃することなく単相性の疾患経過を示した。これらの患者の約25%は、びまん性増殖性腎炎 (diffuse proliferative nephritis) 、精神神経ループス (neuropsychiatric lupus) のような重篤な症状を発症時に有していた。SLE の疾患活動性のパターンに関するこれまでの報告では、単相性患者を捉えることができなかった。比較的短い追跡期間(1-5 年)がこの原因かもしれない。以上より、ループス腎炎のような重篤な臨床症状は、治療開始後数年で消失する可能性がある。したがって、部分寛解の徴候が明らかな場合では、寛解が起こるまでに十分な時間をかけることが妥当であると思われる。
持続的な活動性疾患(一度も寛解に至らないか、6 ヵ月未満の短期間の寛解しか得られない)は約 10%であると報告されている。それ以前の研究では、追跡期間はかなり短かったものの、有意に高い割合(最大 40%)が報告されている。好ましくない経過を決定する因子はまだ判明していない。しかし、服薬アドヒアランスの不良が主な原因であると考えられている。システマティックレビューでは、ループス患者の約 43-75%がアドヒアランス不良であり、約 33%が 5 年後に服薬を自己中断 (arbitrarily discontinue) していることが報告されている。服薬アドヒアランス不良は、ループス患者における再燃率、罹患率、入院率の上昇に関連している。その他の予測因子としては、発症時の疾患活動性の高さ、筋骨格系および皮膚病変が挙げられる。経時的な疾患活動性の異なるパターンを図 2 に示す。
図 2. SLE の疾患活動性の経時的パターン
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#fig2
上記のようなよく知られている疾患活動性のパターンの他に、10%の患者は、最初の 10 年間に 1-8 年の寛解期が 1 回ある珍しい経過を示した。これらの "ハイブリッド "患者は、再発寛解型患者と持続性活動型患者の中間に位置する疾患活動性を示した。10 年後の障害発生は再発寛解型と同様であった。
5-2. 臨床経過が予後に与える影響
疾患の経過は予後を大きく左右する。活動性の持続する患者や再発寛解患者では、不可逆的な障害が増加し、疾患活動性と障害の蓄積の間には直線的な関係があるようである。
長期に渡って寛解を維持している患者でも、後期に何らかの障害が生じた。障害は疾患活動性とグルココルチコイドに関連している。後者は疾患の後期でより顕著になり、グルココルチコイドに長期間さらされた結果である可能性が高い。グルココルチコイドと直接的または間接的に関連する併存疾患(骨粗鬆症、骨壊死、動脈硬化性心血管疾患)は、長期に渡って寛解を維持している患者よりも、活動性が持続し再発寛解を繰り返す患者に多くみられる。関連するすべての研究で、障害は SLICC/ACR Damage Index で評価された。疾患パターンは死亡率にも影響し、持続性活動性疾患では診断後 5 年間の死亡率が高い。
興味深いことに、ほとんどの関連研究では、臨床的寛解期間が障害発生の最も重要な予測因子であった。最初の 10 年間のグルココルチコイドの累積投与量が多いにもかかわらず、最初の 10 年間の 50%以上が寛解だった再発寛解患者では、障害発症の程度は長期寛解を達成した患者(平均寛解期間 8.8 年)と同程度だった。さらに、"ハイブリッド "患者の障害発生の程度は寛解期間によってそれぞれ対応する 3 群に類似していた。他の研究者たちも、白人 SLE 患者では 2 年間の寛解が障害を予防し、5 年間の寛解維持で障害のリスクを 96%減少させることを示した。
完全寛解はまだ厳密には定義されておらず、まれであるため、低疾患活動性 (low disease activity: LDA) は日常診療において、また SLE の新薬の臨床試験においても価値があると思われる。LDA は、完全寛解とは異なるが、障害発生の減少や生存期間の延長など、長期的に良好な転帰をもたらす疾患状態を捉えるものである。
このような背景から、低疾患活動性の定義はここ数年の間に、最小疾患活動性(minimal disease activity: MDA)、LDA 、およびループス低疾患活動性状態(lupus low disease activity state: LLDAS)という異なる定義が出現した。主な違いは(表 6)、SLEDAI-2K で示される許容可能な疾患活動性のレベル(それぞれ 1、2、4)と、許容される治療(LLDAS ではプレドニゾンが 7.5 mg/日まで投与されるが、MDA と LDA では投与されない)である。
表 6. SLE における低疾患活動性の 3 つの定義
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#tbl6
この 3 つの定義はすべて、障害発生や死亡率などの長期転帰への影響について検証されており、LDA の状態は寛解に匹敵する転帰をもたらすことが示されている 。
LDA の持続期間と持続性は、転帰を改善するための最も重要な要素であると思われる。LDA を短期間(例えば、次の疾患再燃までの数ヶ月間)達成しても、長期的には臨床的に意味がない。関連する研究では、LDA の期間が最低でも2年以上あれば、転帰の改善につながることが示されている。興味深いことに、長期追跡を行った研究では、LDA 患者は約 80%の期間を臨床的寛解で経過したと報告されている 。このことは、LDA 患者は観察期間の初期には活動性であり、その後、局所治療で管理可能な軽度の再燃を伴いながら、長期間の臨床的寛解を達成したことを意味する。
LDA の概念は、経時的な疾患活動性パターンを検討する研究には適用されていない。再発寛解患者の再燃の中には、LDA の定義に当てはまるもの(「軽度の再燃」)もあれば、より重篤なもの(「重度の再燃」)もある可能性がある。このことが証明されれば、軽度の再燃のみの患者の治療成績は、寛解が長期化した患者に近づくと考えるのが妥当であろう。一方、大発作を伴う再発寛解患者の転帰は、持続的に活動的な患者の転帰に近づくであろう。このようなデータは、予測モデルの精度をさらに向上させ、早期に患者に合わせた治療アプローチを適用する能力を高める可能性がある。
注目すべきは、血清学的検査(抗 dsDNA 抗体および補体 C3/C4)が疾患の経過パターンに影響しないことである。血清学的に活動的な臨床的休止期(Serologically active clinically quiescent: SACQ)患者は、臨床的および血清学的に寛解期にある患者よりも多くのダメージを受けることはなく、したがって積極的な治療は必要ないが、再燃リスクが増加することがあるので、綿密なサーベイランスが必要である。結論として、臨床的活動性をともなわず、抗 dsDNA 抗体価の単独高値かつ/または C3/C4 低下を認める場合のみが、寛解の定義に含まれるとして、ほとんどの研究者に受け入れられている。とはいえ、臨床的活動性がなくても、疾患再発のリスクが高い時期には、血清学的モニタリングの適応となる。
SACQ 患者は SLE の中でも特に興味深いサブセットである。1970 年代後半に同定された SACQ 患者は、血清学的活性(抗 dsDNA 抗体価の上昇と C3/C4 レベルの低下)と疾患活動性の不一致を理解するために集中的に研究された。抗 dsDNA 抗体と抗クロマチン抗体の性質に関する病態生理の研究では、SACQ 患者と非 SACQ 患者の間に差は認められなかった。さらに、インターフェロン I 型(「インターフェロン・シグネチャー」)および炎症性サイトカイン/ケモカインの発現は、SACQ 患者と血清学的および臨床的に休止している患者との間に差はなく、「自己免疫寛解」の状態を示唆していた。大規模コホートでは、多くの患者が一時的な SACQ 状態を示すことがあるが、この状態を 2 年以上連続して維持できたのは約 6%のみであった。そのうちの約 60%はその後 3 年間に再燃したが、抗 dsDNA 抗体価や補体レベルの変動は信頼できる予測因子ではなかった。臨床的に活動的な患者と比較すると、SACQ 患者は 10 年間の追跡で、障害の蓄積が少なく、心血管イベントが少なく、腎障害が少なかった。
疾患の経過を適切なタイミングで予測することで、長期間寛解を維持している患者(または単相性患者)では早期に治療を中止し、再発寛解患者や活動性が持続している患者では長期間の維持療法を行うなど、患者に合わせて治療計画を立てることができる可能性がある。免疫応答のエフェクターを抑制するか、免疫制御を増強する(またはその両方)遺伝的因子が重要であると考えられるが、エピジェネティックな因子もまた、病態抑制に関与している可能性がある。いくつかの可溶性メディエーターが疾患の発症に関与しており、それらの血清レベルは臨床的再燃の前に変化する。黒人であることおよび最初の 2 年間の疾患活動性の増加(調整平均 SLEDAI-2K で表される)は、疾患の経過と独立して関連していた。このことは、早期の反応が長期にわたる良好な転帰を予測すること、treat-to-target 戦略は寛解、または不可能な場合は LDA 状態を目指すべきであることを示唆している。
6. 高齢発症全身性エリテマトーデス
SLE はどの年齢でも発症する可能性があるが、その発症のピークは生殖年齢に起こる 。高齢発症 SLE と若年性 SLE の年齢的な区切りの定義に合意はない。多くの研究では、高齢発症 SLE(late-onset SLE: LSLE)は 50 歳以降に発症すると定義されている。65 歳以上という第二の定義も提唱されている。しかし、これら 2 つの異なるカットオフ年齢で選択された LSLE 集団を比較したところ、関連する差は認められなかった。LSLE については、若年発症例と比較して発表されたデータが少ない。しかし、疾患活動性、臨床症状、併存疾患、罹患率の違いは、様々な国で証明されている。
6-1. 疫学
患者の 2-20%において、SLE は 50 歳以降に発症する。女性優位は年齢とともに減少し、若年発症例では性比 (女:男) は 7:1-18:1であるが、50 歳を過ぎると 4:1-7:1 になる。この減少は、エストロゲンレベルの変動と関連している。LSLE 患者は主に白人である。
LSLE 患者は診断に時間がかかることが多い。この遅れは、LSLE が非典型的な臨床症状、重要な症状を不明瞭にする併存疾患、高齢者では鑑別疾患として SLE が挙げにくいなどの理由で、診断が遅れると考えられる。
6-2. 臨床的特徴
LSLE 患者では、若年発症の SLE に特徴的な症状、すなわち粘膜、腎臓、筋骨格系の病変が出現する頻度は低い(表 7)。
表 7. 若年発症および高齢発症 SLE における臨床症状の頻度
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#tbl7
これはおそらく免疫老化によるものであろう。LSLE は、より緩徐な発症、より少ない臓器病変、より良性の経過を示すことが広く認められている。しかし、Alonso らは、LSLE 患者でも若年発症 SLE 患者でも、最も頻度の高い臨床症状は関節炎であり、群間に有意差はないと報告している。また、LSLE では筋骨格系の病変がより頻度が高いと報告している著者もいる。Choi らは LSLE では発熱、貧血、血小板減少の頻度が少ないと報告している。Alonso らは、高齢者では痙攣や精神病の頻度が低いことを報告している。加齢に関連した最も重要な違いは、LSLE では腎疾患の発生率と重症度が顕著に低下することであるようだ。LSLE 患者では、心肺機能障害、特に漿液炎と間質性肺疾患(interstitial lung disease: ILD)を発症することが多い。高齢化、喫煙、「免疫老化」と関連して、SLE-シェーグレン症候群(Sjogren's syndrome: SS)重複症候群の患者は、LSLE における ILD のリスクが高い可能性がある。
Riveros Frutos らは、LSLE 患者では血栓塞栓症、深部静脈血栓症、ループスアンチコアグラント陽性の頻度が高いと報告している。一方、Cartella らは、LSLE 患者と若年発症 SLE 患者で血栓症の頻度に有意差はないと報告している。また、抗リン脂質抗体症候群の発症率は、LSLE 患者と若年発症 SLE 患者で有意差はない。
いくつかの研究では、SLE の発症年齢の違いによる主要臓器病変の有意差はみられなかった。Padovan らが報告した唯一の有意差は末梢神経系の病変で、65 歳以上の LSLE サブグループでより頻度が高かった。SLE の重症度は年齢とともに低下するようである。対照的に、Prevete らと Padovan らは、疾患活動性に関して若年発症SLE 患者とLSLE患者の間に差はないとしている。臓器障害は LSLE でより多いようである。この増加は、骨粗鬆症や加齢に伴う罹患率などの異所性の影響による可能性があるが、LSLE がより良性の疾患であるという解釈には疑問がある。
6-3. 高齢発症全身性エリテマトーデスの合併症
LSLE 患者では、診断時に高血圧、脳血管障害、心血管疾患、末梢血管疾患、がん、骨粗鬆症、糖尿病、甲状腺疾患、肥満、うつ病などの複数の既往合併症のリスクが高かった。LSLE 患者の半数では、合併症の負担が増加するのに 1 年未満しかかからず、全死因死亡率への影響(累積発生率 33.3%)も高い。
LSLE 患者は SS を合併することが多い。LSLE と SS を合併する患者のサブセットは、光線過敏症、口腔潰瘍、レイノー現象、抗 Ro 抗体、抗 La 抗体の頻度が高いなど、臨床的・検査的表現型がはっきりしている。LSLE と SS の関係については議論があり、自己免疫性内分泌異常症は SLE の一症状であり、SS は LSLE の二次症状であると主張されている。Feng らは、SS が同時に発症する自己免疫疾患の中で最も多く、非自己免疫疾患の中で最も多いのは高血圧と感染症であるとした。一方、Choi らは、癌、糖尿病、甲状腺疾患の有病率に有意差を認めなかった。年齢を一致させた一般集団における高血圧の有病率を比較しても、有意差はなかった。したがって、高血圧は SLE の結果というより加齢の結果である可能性がある。
6-4. 臨床検査の特徴
LSLE 患者では、抗 dsDNA 抗体、抗ヌクレオソーム抗体、抗 Sm 抗体、抗 RNP 抗体、ループスアンチコアグラント陽性の頻度が低い。C3、C4、CH50 を含む補体レベルの低下も LSLE では少ないことが報告されている(表 8)。
表 8. 若年発症および高齢発症全身性エリテマトーデスの血清学的特徴
https://www.sciencedirect.com/science/article/pii/S1521694224000093?via%3Dihub#tbl8
このような血清学的プロフィールは、疾患活動性に影響を与えるか、あるいは反映する可能性がある。リウマトイド因子(rheumatoid factor: RF)、抗 Ro/SS-A 抗体、抗 La/SS-B 抗体の頻度が高いなど、非典型的な免疫学的プロフィールを報告している研究もある。前者は、RF が 65 歳以降に高頻度で陽性となることと関連している可能性がある。一方、Padovan らは LSLE で抗 dsDNA 抗体価が有意に高いことを報告しており、Wen らは SLE 発症年齢群間で抗体プロファイルに有意差があることを報告している。SS は LSLE 患者でより多かったが、韓国のコホート研究では抗 Ro/SS-A 抗体と抗 La/SS-B 抗体の有病率に差はみられなかった。この研究でも、LSLE における自己抗体プロファイルとループス腎炎との間に関連は認められなかった 。炎症マーカー、すなわち赤血球沈降速度や C 反応性蛋白の上昇は、異なる年齢層間で有意な差はないようである。
6-5. 治療
いくつかの研究では、コルチコステロイドとヒドロキシクロロキンの使用頻度は、発症年齢群間で有意差はなかった。対照的に、Feng らは、LSLE ではヒドロキシクロロキンの使用頻度が低いことを明らかにしている。LSLE では合併症の可能性が高く、有害な転帰と相関していることから、グルココルチコイドの使用や、それに関連する骨粗鬆症、糖尿病、高血圧、気分障害のリスクを最小限に抑えるなど、合併症の影響を予防または軽減するための戦略を強化すべきである。Sohn らは、免疫抑制薬の使用頻度は LSLE と若年発症 LSE で差がなかったと報告している。対照的に、LSLE ではシクロホスファミドとアザチオプリンの使用頻度が有意に低いことが報告されており、このことは、LSLE では若年患者に比べて疾患活動性が低いことを示唆している。Padovan らは、65 歳以上の LSLE 患者 30 人の治療には免疫抑制薬は使用されなかったと報告している。
6-6. 予後
入院患者のコホートにおいて、LSLE の SLEDAI-2K スコアは、退院時に若年患者よりも有意に低下する傾向があり、LSLE は治療に対してより感受性が高い可能性が示唆された。Alonso らは、若年発症患者と LSLE で再燃頻度に有意差はないとしている。
Sohn らは、LSLE の標準化死亡率は一般集団の死亡率より高くないとしているが、LSLE 患者は年齢的に若年発症の SLE 患者より生存確率が低い。Feng らは、LSLE 患者の死亡率の半分近くが感染症、特に肺感染症によるもので、若年発症患者と比較して頻度が高いことを観察している。臓器障害/SLE 関連死亡率に有意差はなかった。LSLE における死亡との独立した関連はなかったが、抗 Sm 抗体陽性とヒドロキシクロロキンの使用は防御因子であると報告されており、これらの患者では頻度が低かった。対照的に、Cartella らは、LSLE における死亡の主な原因は心血管疾患であると報告している。全体的に死亡率が高いのは、LSLE では合併症の負担が大きいこと、加齢による臓器障害があること、従来の心血管危険因子に長くさらされていることが関係している可能性がある。LSLE の死亡率をよりよく理解するための長期的な前向き研究が不足している。
7. 結論
SLE の診断と分類には、前臨床期と初期臨床期が存在する可能性があり、これらの病期を認識することにより、予防策を採用し、早期診断と適時の治療介入を確保すべきである。このことは、SLE 患者の予後に良い影響を与える。まれなことではあるが、高齢の患者において SLE と診断される可能性を否定すべきではない。SLE 発症時の年齢は疾患の予後を左右する重要な因子のひとつである。若年発症の SLE はより活発な免疫学的プロフィールと相関しているようであるが、LSLE は合併症の発生率が高く、診断が遅れることが多い。
診断後の経過は、ほとんどの患者で再発寛解型であるが、約 20%は持続的活動性または長期寛解型である。長期の SACQ 患者は、臨床的に活動的な患者に比べ、障害が少ない傾向がある。寛解期間と累積グルココルチコイド曝露が予後の最も重要な因子である。特に LSLE では、併存疾患のコントロールに重点を置いた管理が必要である。遺伝的因子、血清学的所見、人口統計学的/臨床的特徴に基づいたマルチパラメトリック予測モデルは、疾患の経過を早い段階で認識し、それに合わせた治療アプローチを行うのに役立つであろう。最適な医療を提供するためには、SLE の発症年齢の違いによる臨床的差異を認識することが重要である。
8. 臨床におけるポイント
8-1. 前臨床期全身性エリテマトーデス
·SLE は ANA を含む自己抗体の蓄積を特徴とする前臨床期が長く続くことがある。
·ANA 検出のための間接免疫蛍光 Hep-2 アッセイは、SLE が疑われる集団を絞り込むための高感度スクリーニング検査として使用されなければならない。
·いくつかの環境因子、行動、条件が SLE 発症リスクを高める可能性がある。
8-2. 不全型全身性エリテマトーデス
·分類基準は標準化された定義であり、診断を下したり、すべての可能性のある患者を捕らえることを意図しているのではなく、科学的な目的のために均質なコホートを作成することを目的としている。
·診断は、訓練を受けた医師の判断に依存し、SLE に類似した鑑別疾患を除外する必要があるため、分類とは異なる。
·SLE の最大 50%の症例で診断時には分類基準を満たさない。
·iSLE は、SLE の臨床診断において、臨床症状や血清学的症状は SLE に一致するが、分類基準を満たすには不十分な状態を示す。
·HCQ を使用し、修正可能な環境的危険因子(喫煙習慣や無防備な日光暴露など)を除去することで、UCTD や iSLE から分類可能な SLE への進展を遅らせることができる。
8-3. 早期全身性エリテマトーデス
·早期 SLE とは、不全型 SLE や分類可能な確定型 SLE を含め、臨床的発症が最近に診断されたものをいい、早期に診断することはよりよい転帰をもたらす可能性がある。
·レッドフラッグの作成やスクリーニングツールの導入は、リウマチ専門医への紹介時間を短縮し、早期診断に役立つ可能性がある。
·寛解または LDA を目標に治療し、HCQ を追加し、併存疾患に対処し、プレドニゾンの使用を 5 mg/日以下にすることで、疾患の初期段階から統合的なアプローチを実施することは、新たに SLE と診断された患者における早期の障害発生を減少させるのに役立つであろう。
8-4. 全身性エリテマトーデスの臨床経過のパターン
·SLE の診断後の経過は、再発寛解型(50-70%)、長期休止型(10-31%)、慢性活動型(10-19%)である。
·活動性の持続する疾患の決定因子は、服薬アドヒアランスが悪いこと、発症時の疾患活動性が高いこと、筋骨格系や皮膚の病変があることである。
8-5. 全身性エリテマトーデス診断における臨床経過の影響
·臨床的に活動的な人に比べ、血清学的に活動的で臨床的に不活発な患者では、10 年間の追跡調査において、障害の発生、心血管イベントの発生、腎障害の発生が少ない。したがって、積極的な治療は必要ないが、注意深い監視が必要である。
·疾患の経過をタイミング良く予測することは、治療アプローチ(例えば、長期間寛解を維持している患者では早期に治療を中止し、再発寛解を繰り返す患者では維持療法を延長する)に役立つ。
8-6. 高齢発症全身性エリテマトーデスの疫学
·SLE は 2-20%の患者で 50 歳以降に発症する(高齢発症 SLE)。
·LSLE は臨床症状が非典型的であること、併存疾患により重要な症状が不明瞭であること、高齢者に SLE が発症していると考えにくいことにより、診断が遅れがちである。
8-7. 高齢発症全身性エリテマトーデスの臨床的特徴
·LSLE はより緩徐に発症し、疾患活動性は低いが、臓器障害の頻度は大きい。
·LSLE では粘膜、腎臓、筋骨格系病変の頻度は低い。
8-8. 高齢発症全身性エリテマトーデスの併存疾患
·LSLE 患者では診断時に複数の既往合併症のリスクが高い。
·光線過敏症、口腔潰瘍、レイノー現象、抗 Ro/SS-A 抗体、抗 La/SS-B 抗体の頻度が高い。
8-9. 高齢発症全身性エリテマトーデスの検査所見
·LSLE 患者では、抗 dsDNA 抗体、抗ヌクレオソーム抗体、抗 Sm 抗体、抗 RNP抗体、ループスアンチコアグラント陽性の頻度が低く、リウマチ因子抗体、抗 Ro/SS-A 抗体、抗 La/SS-B 抗体の頻度が高い。
8-10. 高齢発症全身性エリテマトーデスの管理
·SLE の管理は、併存疾患を予防したり、その影響を軽減するための戦略に重点を置くべきであり、グルココルチコイドの使用とそれに関連する骨粗鬆症、糖尿病、高血圧、気分障害のリスクを最小限にすることである。
8-11. 高齢発症全身性エリテマトーデスの予後
·早期発症患者と後期発症患者のフレア頻度に有意差はみられなかった。
·LSLE 患者は若年発症 SLE 患者より生存確率が低い。その理由は年齢だけでなく、合併症の負担が大きいこと、臓器障害があること、心血管危険因子に長期間さらされていることなどである。
9. 研究課題
·SLE における治療機会のウィンドウの存在を証明し、その期間を明確にし、その可能性を最大限に引き出すためには、さらなる証拠が必要である。
·遺伝的要因、人種・民族的要因、血清学的マーカー、インターフェロン I 型(「インターフェロン・シグネチャー」)、炎症性サイトカイン・ケモカインなど、疾患の経過を予測する要因をさらに調査する必要がある。
·臓器障害や死亡率を減少させるために、SLE の症状や併存疾患を早期に診断し治療するための戦略を立案し実施すべきである。
https://pubmed.ncbi.nlm.nih.gov/38388232/