モデルナのmRNA-1273ワクチンによる抗体依存性感染増強ADEを起こすと懸念されている結合抗体の誘導
論文本文より抜粋
The mRNA-1273 vaccine was immunogenic, inducing robust binding antibody responses to both full-length S-2P and receptor-binding domain in all participants after the first vaccination in a time- and dose-dependent fashion.
mRNA-1273ワクチンは免疫原性があり、最初のワクチン接種後の時間および用量依存的な方法で、すべての参加者の全長S-2Pと受容体結合ドメインの両方に強力な結合抗体応答を誘導しました。
+++++++++++++++++++++++++++++
NEJM モデルナmRNA-1273ワクチン臨床試験: 抗体依存性感染増強ADEを起こす結合抗体の誘導
New England Journal of Medicineのモデルナ社のmRNAワクチンの臨床試験の論文
An mRNA Vaccine against SARS-CoV-2 — Preliminary Report
SARS-CoV-2に対するmRNAワクチン—予備報告
List of authors.
Lisa A. Jackson, M.D., M.P.H., Evan J. Anderson, M.D., Nadine G. Rouphael, M.D., Paul C. Roberts, Ph.D., Mamodikoe Makhene, M.D., M.P.H., Rhea N. Coler, Ph.D., Michele P. McCullough, M.P.H., James D. Chappell, M.D., Ph.D., Mark R. Denison, M.D., Laura J. Stevens, M.S., Andrea J. Pruijssers, Ph.D., Adrian McDermott, Ph.D., et al., for the mRNA-1273 Study Group*
July 14, 2020、DOI: 10.1056/NEJMoa2022483
Abstract要約
BACKGROUND背景
The severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) emerged in late 2019 and spread globally, prompting an international effort to accelerate development of a vaccine.
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は2019年後半に出現し、世界中に広まり、ワクチンの開発を加速させる国際的な取り組みを促しました。
The candidate vaccine mRNA-1273 encodes the stabilized prefusion SARS-CoV-2 spike protein.
候補ワクチンのmRNA-1273は、安定化されたプレフュージョンSARS-CoV-2スパイクタンパク質をコードしています。
METHODS方法
We conducted a phase 1, dose-escalation, open-label trial including 45 healthy adults, 18 to 55 years of age, who received two vaccinations, 28 days apart, with mRNA-1273 in a dose of 25 μg, 100 μg, or 250 μg.
18〜55歳の45人の健康な成人を含み、25μg、100μg、または250μgの用量のmRNA-1273で28日間隔で2回のワクチン接種を受けた、フェーズ1、用量漸増、オープンラベル試験を実施しました。
There were 15 participants in each dose group.
各用量群には15人の参加者がいた。
RESULTS結果
訳注:
以下の記載には、抗体依存性感染増強ADEを起こすと懸念されている「binding antibody結合抗体」という言葉が使用されていません。
明らかにゆがめられた記載であり、典型的なスピンSpinと呼ばれる誤魔化しです。
大部分の論文の読者は、要旨Abstractしか読まないのが普通であり、その大多数の人の習性を利用して、Abstractには都合の悪いことを書かない「Spinスピン」と呼ばれる騙しの手口が横行しています。
今回のNEJMのモデルナワクチンの論文にも、この悪質な手口スピンが使われ、騙しが行われています。
(訳注終わり)
After the first vaccination, antibody responses were higher with higher dose (day 29 enzyme-linked immunosorbent assay anti–S-2P antibody geometric mean titer [GMT], 40,227 in the 25-μg group, 109,209 in the 100-μg group, and 213,526 in the 250-μg group).
最初のワクチン接種後、抗体反応は高用量でより高かった(29日酵素結合免疫吸着アッセイ抗S-2P抗体幾何平均力価[GMT]、25-μgグループで40,227、100-μgグループで109,209、および 250-μgグループでは213,526)。
After the second vaccination, the titers increased (day 57 GMT, 299,751, 782,719, and 1,192,154, respectively).
2回目のワクチン接種後、力価は増加した(GMT 57日、299,751、782、719、および1,192,154)。
After the second vaccination, serum-neutralizing activity was detected by two methods in all participants evaluated, with values generally similar to those in the upper half of the distribution of a panel of control convalescent serum specimens.
2回目のワクチン接種後、評価したすべての参加者において、2つの方法で血清中和活性が検出され、コントロール回復期血清検体のパネルの分布の上半分の値とほぼ同様の値でした。
Solicited adverse events that occurred in more than half the participants included fatigue, chills, headache, myalgia, and pain at the injection site.
参加者の半数以上で発生した自発的な有害事象には、疲労、悪寒、頭痛、筋肉痛、注射部位の痛みがあった。
Systemic adverse events were more common after the second vaccination, particularly with the highest dose, and three participants (21%) in the 250-μg dose group reported one or more severe adverse events.
全身有害事象は2回目のワクチン接種後、特に最高用量でより一般的であり、250μg用量群の3人の参加者(21%)が1つ以上の重篤な有害事象を報告しました。
CONCLUSIONS結論
The mRNA-1273 vaccine induced anti–SARS-CoV-2 immune responses in all participants, and no trial-limiting safety concerns were identified.
mRNA-1273ワクチンは、すべての参加者に抗SARS-CoV-2免疫応答を誘発し、試験を制限する安全性の懸念は確認されていません。
These findings support further development of this vaccine.
これらの発見は、このワクチンのさらなる開発をサポートしています。
(Funded by the National Institute of Allergy and Infectious Diseases and others; mRNA-1273 ClinicalTrials.gov number, NCT04283461. opens in new tab).
+++++++++++++++++++++++++++++
論文本文
方法の部分
ASSESSMENT OF SARS-COV-2 BINDING ANTIBODY AND NEUTRALIZING RESPONSES
SARS-COV-2結合抗体および中和反応の評価
Binding antibody responses against S-2P and the isolated receptor-binding domain, located in the S1 subunit, were assessed by enzyme-linked immunosorbent assay (ELISA).
S-2PおよびS1サブユニットにある分離された受容体結合ドメインに対する結合抗体応答は、酵素結合免疫吸着測定法(ELISA)によって評価されました。
+++++++++++++++++++++++++++
訳注
要旨Abstractではbinding antibody結合抗体という言葉を使用していませんが、本文の結果のこの部分では使用しています。
大部分の論文の読者は、要旨Abstractしか読まないのが普通であり、その大多数の人の習性を利用して、Abatractには都合の悪いことを書かない「Spinスピン」と呼ばれる騙しの手口が横行しています。
今回のNEJMのモデルナワクチンの論文にも、この悪質な手口スピンが使われ、騙しが行われています。
(訳注終わり)
SARS-COV-2 BINDING ANTIBODY RESPONSES
SARS-COV-2結合抗体応答
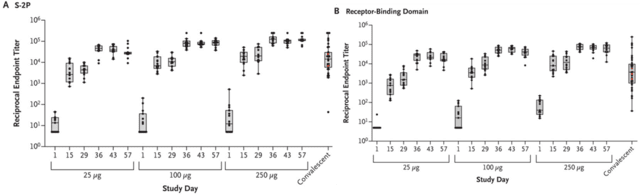
Binding antibody IgG geometric mean titers (GMTs) to S-2P increased rapidly after the first vaccination, with seroconversion in all participants by day 15 (Table 2 and Figure 2A).
S-2Pへの結合抗体IgG幾何平均力価(GMT)は、最初のワクチン接種後に急速に増加し、15日目までにすべての参加者でセロコンバージョンが発生しました(表2および図2A)。
Dose-dependent responses to the first and second vaccinations were evident.
1回目と2回目のワクチン接種に対する用量依存的反応は明らかでした。
Receptor-binding domain–specific antibody responses were similar in pattern and magnitude (Figure 2B).
受容体結合ドメイン特異的抗体反応は、パターンと大きさが類似していた(図2B)。
For both assays, the median magnitude of antibody responses after the first vaccination in the 100-μg and 250-μg dose groups was similar to the median magnitude in convalescent serum specimens, and in all dose groups the median magnitude after the second vaccination was in the upper quartile of values in the convalescent serum specimens.
どちらのアッセイでも、100-μgおよび250-μg用量群の初回ワクチン接種後の抗体反応の中央値は、回復期の血清検体の中央値と同様でした。そして、すべての用量群において、2回目のワクチン接種後の中央値は、回復期の血清検体の値の上四分位でした。
The S-2P ELISA GMTs at day 57 (299,751 [95% confidence interval {CI}, 206,071 to 436,020] in the 25-μg group, 782,719 [95% CI, 619,310 to 989,244] in the 100-μg group, and 1,192,154 [95% CI, 924,878 to 1,536,669] in the 250-μg group) exceeded that in the convalescent serum specimens (142,140 [95% CI, 81,543 to 247,768]).
57日目のS-2P ELISA GMT(25マイクログラムグループでは299,751 [95%信頼区間{CI}、206,071から436,020]、100マイクログラムグループでは782,719 [95%CI、619,310から989,244]、および1,192,154 [250-μgグループの[95%CI、924,878〜1,536,669])は、回復期の血清検体のそれ(142,140 [95%CI、81,543〜247,768])を超えました。
Discussion議論(抜粋)
結合抗体に関する議論
The mRNA-1273 vaccine was immunogenic, inducing robust binding antibody responses to both full-length S-2P and receptor-binding domain in all participants after the first vaccination in a time- and dose-dependent fashion.
mRNA-1273ワクチンは免疫原性があり、最初のワクチン接種後の時間および用量依存的な方法で、すべての参加者の全長S-2Pと受容体結合ドメインの両方に強力な結合抗体応答を誘導しました。
Commensurately high neutralizing antibody responses were also elicited in a dose-dependent fashion.
相応して高い中和抗体反応も用量依存的に誘発された。
Seroconversion was rapid for binding antibodies, occurring within 2 weeks after the first vaccination, but pseudovirus neutralizing activity was low before the second vaccination, which supports the need for a two-dose vaccination schedule.
最初のワクチン接種後2週間以内に発生する結合抗体については、セロコンバージョンは迅速でしたが、2回目のワクチン接種スケジュールの必要性をサポートする2回目のワクチン接種前の偽ウイルス中和活性は低かった。
結合抗体による抗体依存性感染増強ADEに関する議論
Previous experience with veterinary coronavirus vaccines and animal models of SARS-CoV and MERS-CoV infection have raised safety concerns about the potential for vaccine-associated enhanced respiratory disease.
獣医コロナウイルスワクチンと、SARS-CoVおよびMERS-CoV感染の動物モデルに関するこれまでの経験から、ワクチン関連の呼吸器疾患の増進の可能性に関する安全上の懸念が生じています。
These events were associated either with macrophage-tropic coronaviruses susceptible to antibody-dependent enhancement of replication or with vaccine antigens that induced antibodies with poor neutralizing activity and Th2-biased responses.31
これらの事象は、複製の抗体依存性増強に感受性のあるマクロファージ向性コロナウイルス、または中和活性が低い抗体とTh2バイアス応答を誘導するワクチン抗原のいずれかに関連していた。
Reducing the risk of vaccine-associated enhanced respiratory disease or antibody-dependent enhancement of replication involves induction of high-quality functional antibody responses and Th1-biased T-cell responses.
ワクチン関連の強化された呼吸器疾患または複製の抗体依存性の強化のリスクを減らすには、高品質の機能的抗体応答およびTh1偏向T細胞応答の誘導が含まれます。
Studies of mRNA-1273 in mice show that the structurally defined spike antigen induces robust neutralizing activity and that the gene-based delivery promotes Th1-biased responses, including CD8 T cells that protect against virus replication in lung and nose without evidence of immunopathology.32
マウスにおけるmRNA-1273の研究は、構造的に定義されたスパイク抗原が強力な中和活性を誘発し、遺伝子ベースの送達が、免疫病理学の証拠なしに肺および鼻でのウイルス複製から保護するCD8 T細胞を含むTh1バイアス応答を促進することを示しています。
It is important to note that mRNA-1273 also induces Th1-biased CD4 T-cell responses in humans. Additional testing in animals and ongoing T-cell analysis of clinical specimens will continue to define the safety profile of mRNA-1273.
mRNA-1273はまた、ヒトにおいてTh1に偏ったCD4 T細胞応答を誘導することに注意することが重要です。 動物での追加の試験と臨床検体の進行中のT細胞分析により、mRNA-1273の安全性プロファイルが引き続き定義されます。
These safety and immunogenicity findings support advancement of the mRNA-1273 vaccine to later-stage clinical trials.
これらの安全性と免疫原性の発見は、mRNA-1273ワクチンの後期臨床試験への進歩をサポートします。
Of the three doses evaluated, the 100-μg dose elicits high neutralization responses and Th1-skewed CD4 T cell responses, coupled with a reactogenicity profile that is more favorable than that of the higher dose.
評価された3つの用量のうち、100μgの用量は高い中和反応とTh1歪んだCD4 T細胞反応を誘発し、より高い線量よりも好ましい反応原性プロファイルと相まっています。
A phase 2 trial of mRNA-1273 in 600 healthy adults, evaluating doses of 50 μg and 100 μg, is ongoing (ClinicalTrials.gov number, NCT04405076. opens in new tab).
50μgと100μgの用量を評価する600人の健康な成人におけるmRNA-1273の第2相試験が進行中です(ClinicalTrials.gov番号、NCT04405076。新しいタブで開きます)。
A large phase 3 efficacy trial, expected to evaluate a 100-μg dose, is anticipated to begin during the summer of 2020.
100μgの用量を評価すると予想される大規模な第3相有効性試験が2020年の夏に開始される予定です。
訳注
簡単に言えば、「結合抗体による抗体依存性感染増強ADEよりも、中和抗体の能力が凌駕するから、安全性に問題はない」と言っています。
しかし、それを証明する動物による安全性実験は、実施しないことが全世界の合意で決められてワクチン開発が進められているため、mRNA-1273 Study Groupの学者たちが口先で言っているだけでは、安全性の証拠はありません。
つまり、机上の空論、絵に描いた餅、空手形に過ぎない代物であり、証拠がない以上、科学者が安全だと言ってはならないことです。
そして、そんな代物に過ぎないワクチンは使用してはならないのです。
(訳注終わり)
+++++++++++++++++++++++++++++++++++++++
コロナワクチン開発の安全性を無視した異常な状況と、予測される抗体依存性感染増強ADE
コロナワクチンの危険性に関しては、次のブログ記事を参照
ロバートF.ケネディJr.: コロナワクチンとその他のワクチンの危険性、超国家組織の隠された意図(コロナを悪用した支配)を警告
ロバートF.ケネディ・Jr: ファウチ・NIH・モデルナ: ワクチン腐敗、安全性の偽装
モデルナのワクチンは3本針 電極で遺伝物質を細胞内に入れる遺伝子療法、前代未聞の代物
2020/05/26追加 モデルナのmRNAワクチン: 結合抗体がADEを起こす超危険なワクチン
新型コロナ超限戦: F.ウィリアム イングドール コロナウイルスワクチンに対するワープスピードのごり押し
新型コロナ超限戦: アメリカ軍事ワクチン強制か? Operation Warp Speed (ワープスピード作戦)
No.1ロバートFケネディJr 新型コロナとワクチンの最新情報1
No.2ロバートFケネディJr 新型コロナとワクチンの最新情報2
「新型コロナ超限戦」アメリカは「抗体依存性感染増強ADE」を無視してコロナワクチン開発を強行: ジェノサイドは必至
新型コロナ『超限戦』mRNAワクチンの副作用: 抗体依存性感染増強ADEによる死亡リスク増強
『NHK・朝日がコロナワクチンの抗体依存性感染増強ADEを報道』を以下に再録
金融権力の飼い犬の日本政府による大本営発表を垂れ流す放送局NHKが、6月30日になって初めて抗体依存性感染増強ADEの報道を始めました。これは、遅すぎる報道です。
7月1日に検索したところ、2件がヒットしました。朝日新聞の6月16日の報道も末尾に添付しておきます。
(1)過去のADEの実績も1つのニュースで要約されています
新型コロナウイルスの遺伝情報でワクチンの開発 長崎大学
NHKニュース2020年6月30日
「実際に、SARSやMERSといった過去のコロナウイルスのワクチン開発の過程では、動物実験でワクチンを接種すると、症状が悪化したケースがあったということです。
また、1960年代に行われた乳幼児に肺炎などを引き起こすRSウイルスのワクチンの臨床試験では、有効な抗体が作られなかっただけでなく、ワクチンを接種した後にRSウイルスに感染した際にかえって悪化し、死に至るケースもあったということです。
さらに、フランスの製薬企業が開発したデング熱のワクチンは、フィリピンで接種後にウイルスに感染した子どもが死亡したケースが報告されて接種が中止され、ADEが起きた可能性が指摘されています。」
(2)コロナワクチン開発の安全性を無視した異常な状況が述べられています。
国内初 ワクチンの臨床試験開始 大阪のベンチャー 新型コロナ
NHKニュース 2020年6月30日
東京大学医科学研究所の石井健教授
「通常、感染症のワクチンを開発する場合、感染症を防御できることを動物を使った実験で確認しなければいけないが、各国が同意して、動物の実験なしで人での臨床試験が始まっている。3つの段階の臨床試験も、1つが終わってから次に取りかかるのではなく、同時に進めることで早く開発しようと世界中が努力している」
*ブログ著者コメント
『各国が同意して、動物の実験なしで人での臨床試験が始まっている』という現実は、本来必要なワクチンの動物実験による効果と安全性の確認を無視したものであり、これは非常に危険な方法です。
通常は、動物実験で結合抗体とADEの発生の有無を確認するのが当たり前です。
この方法ならば、たとえ動物実験によるADEが起きても、死ぬのは動物だけであり、人の健康や命に問題は出ません。
これをやらずに、いきなり人に投与するのは、ナチスドイツによる人体実験を裁いた、ニュルンベルグ綱領に違反する犯罪行為です。こんなものは、到底受け入れられないものです。今のコロナワクチン開発は、ナチスと同じことをやっているのです。
ニュルンベルク綱領 出典: フリー百科事典『ウィキペディア(Wikipedia)』
全世界でこのようなナチス的な蛮行が行われているのは、世界を支配している金融権力の命令により各国政府と衛生当局がでっち上げた新型コロナの死亡者数を背景に、金融権力が全世界に命令を出して、ADEを無視・軽視するワクチン開発を強行していることが原因です。
「金融権力の頂点にいる者」参照。
WHO, FDA,CDC, EUのEMA, 日本の厚労省などの衛生当局、Lancet, JAMA, NEJM, BMJのような世界の4大医学雑誌やNatureのような世界的な権威のある科学雑誌などが、このコロナワクチンは安全だ、ADEはないことが証明された、安心して打ちなさい、と言ったり、論文や文書に書いたりしても、絶対に信用してはいけません。
これらの関係者は全て、金融権力に支配され、その命令を実行している工作部隊です。
金融権力に支配された科学者や医師や国や行政当局は、どんな嘘でもつきますし、どんな捏造でもやります。
金融権力の奴等の言うことを信じれば、コロナワクチンによる死、重篤な害反応による永続する苦しみが待っているだけです。
5年か10年後に、コロナワクチンの疫学調査が報告されて、死亡リスクが数倍から数十倍だったという恐ろしい事実が学術文献で報告されるでしょうが、それが一般向けのマスコミで報道される可能性は低いと思います。
つまり、真相はマスコミ報道されずに闇に葬られるのです。
カナダのGlobal Researchの報道によると、アメリカ・モデルナのmRNAワクチンは、結合抗体が50%以上の人に生成しますから、ADEは現実のものになると推定されます。
この事実は、日本のマスコミは報道していません。
モデルナのワクチンに関しては、日本のバイオテクノロジーの専門誌である日経バイオテク2020.6.1号のp.14-15に「米Moderna社、新型コロナワクチンの第1相の中間解析のデータ詳細、2つの群の最初の8例で中和抗体の誘導を確認」という記事が掲載されました。
しかし、この記事には次の事実(2)は全く書かれていません。また、(1)については、書かれていますが「グレード3以上の有害事象は、・・・群の3例で2回目の接種後に認められた全身症状だけで、いずれも一時的なものだった」というように、問題ないように誤認させる誤った記載がされています。
恐ろしい真実を隠して、コロナワクチンの開発は進められているのです。
参考ブログ記事
2020/05/26追加 モデルナのmRNAワクチン: 結合抗体がADEを起こす超危険なワクチン
(1)高用量群(250 mcg)の15人の人間のモルモットのうち3人は、モデルナのワクチン接種を受けてから43日以内に「深刻な有害事象」を経験した。モデルナは、3人のボランティアがFDAによって「日常の活動の防止と医療介入の必要性」と定義されているグレード3の全身性イベントを発症したことを認めた。その反応率を持つワクチンは、「地球上のすべての人」に投与された場合、15億人に重傷を負わせる可能性があります。
(2)モデルナの「安全で強力な免疫応答を誘発した」という発表とは異なり、フェイズIの45人の半分以上にできたのは、コロナウイルスの再感染時に「抗体依存性感染増強(Antibody Dependent Enhancement:ADE)」を起こして死亡率を増加させる結合抗体であり、ウイルスを中和する中和抗体ではありません。また、モデルナは、ウイルスとの闘いに不可欠なT細胞の活動を報告していません。
+++++++++++++++++++++++++
国内初 ワクチンの臨床試験開始 大阪のベンチャー 新型コロナ
NHKニュース 2020年6月30日 21時57分
新型コロナウイルスのワクチンを人に投与して、安全性や有効性を確かめる臨床試験を、大阪 茨木市にあるバイオベンチャー企業が30日、開始したと発表しました。新型コロナウイルスのワクチンの臨床試験が国内で始まるのは初めてです。
臨床試験を開始したと発表したのは、大阪大学の研究者が設立したバイオベンチャー企業「アンジェス」です。
発表によりますと、臨床試験では「DNAワクチン」と呼ばれるタイプのワクチンを、健康な成人30人に、大阪市立大学医学部附属病院で投与する計画です。
このワクチンは、ウイルスそのものは使わずに、ウイルスの表面にあって細胞に感染する際の足がかりとなる「スパイクたんぱく質」の遺伝子を使います。
その遺伝子を組み込んだ物質を人に注射することで、体内にスパイクたんぱく質が現れ、それに応じて免疫の仕組みで感染を防ぐ抗体ができるとされています。
投与は2週間あけて2回行い、投与量が少ない15人と、多い15人を比べて、安全性や感染を防ぐ抗体が作られるかどうかを確認するということです。
会社側によりますと、DNAワクチンを作るのに必要な物質は、大腸菌に組み込んでタンクで培養することで、短時間で大量に増やせるということで、素早いワクチン製造が可能だとしています。
新型コロナウイルスのワクチンの臨床試験は、アメリカや中国などですでに始まっていますが、国内では初めてで、この会社の関係者は、ことし秋には次の段階の臨床試験に進みたいとしています。
専門家「臨床試験開始はゴールではなく始まり」
ワクチン開発に詳しい東京大学医科学研究所の石井健教授は、新型コロナウイルスのワクチンの臨床試験が国内で初めて、大阪で始まることについて「臨床試験が始まったことはゴールではなくて始まりと言える。プロトタイプ(=原型)を人に投与して、安全性はもちろんのこと、効くのか効かないのかを最終的に見極める実験が始まった段階だ。臨床試験で最も重要なのは安全性をとことん見極めることだ」と話し、期待が先行することに警鐘を鳴らしました。
また、DNAワクチンは、これまでに実用化されたことがない新しい技術だとしたうえで「安全性の危惧が指摘されたこともあったが、動物用の医薬品としては承認され、いまはワクチン自体の安全性は問題ないとされている。ただ、本当に感染を防御できるだけの免疫を誘導できるのかや、何千万人もの人に投与する大量生産ができるのかが、これから問題になる」と指摘しました。
一般的には長い年月かかるワクチン開発
ワクチン開発に詳しい東京大学医科学研究所の石井健教授によりますと、ワクチンの開発には一般的に10年単位の長い年月がかかるということです。
基礎研究を何年も続けたうえで、非臨床試験という細胞を使った試験管レベルでの実験や動物を使った実験を積み重ねて、人に接種するワクチンを作ります。
続いて実際に人に投与して安全性や有効性を確かめる臨床試験を3段階で行うことが世界的な基準となっています。
臨床試験は、
▽数十人程度の少人数に接種して主に安全性を確かめる第1段階
▽数百人に接種して有効性を詳しく確かめる第2段階
▽数千人の規模で接種して、さらに検証する第3段階
の順で行われ、3つの段階で安全性と有効性を確認したうえで、国による審査で承認されたものが製品化されます。
一連の研究、開発で早くても5年、長いものでは20年から25年かかるほか、動物実験の段階で効果があるとされても、その後の臨床試験で人への有効性や安全性が十分ではないと判断され、開発が中止になるケースもあり、数多くの研究の中から実用化にこぎ着けるのはわずかだとされています。
新型コロナウイルスのワクチン開発は、異例のスピードで進んでおり、石井教授は「通常、感染症のワクチンを開発する場合、感染症を防御できることを動物を使った実験で確認しなければいけないが、各国が同意して、動物の実験なしで人での臨床試験が始まっている。3つの段階の臨床試験も、1つが終わってから次に取りかかるのではなく、同時に進めることで早く開発しようと世界中が努力している」と話しています。
ワクチン開発で重要なのは安全性と有効性の確認
ワクチンは毒性を無くしたウイルスや、ウイルスに似せた無害な物質を体に投与することで免疫に「抗体」を作らせ、病原体の形を体に覚えさせて、その後の感染を防ぎます。
ワクチンの開発を進めるうえで最も重要なのは、ワクチンの安全性と有効性の確認です。
安全性で懸念されることの一つが、ADE=抗体依存性感染増強という現象です。
抗体は、本来であればウイルスから体を守るものですが、ADEは、ワクチンの接種後、ウイルスに感染したとき、かえって感染を促進して症状を悪化させる現象です。
なぜ、この現象が起きるのか詳しい仕組みは、まだ解明されていません。
実際に、SARSやMERSといった過去のコロナウイルスのワクチン開発の過程では、動物実験でかえって症状が悪化したケースがあったということで、安全性を慎重に確かめることが求められます。
また、ワクチンの有効性を確かめるうえでは、どのような種類の抗体が作られるのかも重要です。
免疫機能が働いて抗体が作られても、すべての抗体が新たな感染を防ぐわけではありません。
さまざまな種類がある抗体のうち、中和抗体と呼ばれるものでなければ感染を防ぐことができません。
作られた抗体が中和抗体かどうかは、この抗体を加えた細胞にウイルスを感染させる実験を行って確認するほか、動物を使った実験で確認することもあります。
一般的には、これらの実験が行われたあとで、人に投与する臨床試験が進められます。
+++++++++++++++++++++++++
新型コロナウイルスの遺伝情報でワクチンの開発 長崎大学
NHKニュース2020年6月30日
新型コロナウイルスのワクチン開発が世界中で進められる中、感染症研究の歴史が長い長崎大学では、ウイルスの遺伝情報を使った独自のワクチンの開発に取り組んでいます。
新型コロナウイルスのワクチン開発をめぐっては、世界中で数多くの研究が進められていて、一部では実用化に向けた臨床試験も始まっています。
こうした中、感染症研究で知られる長崎大学も独自のワクチン開発に取り組んでいます。
開発中のワクチンは、新型コロナウイルスの遺伝情報を含むRNAを人工的に合成し、これをヒトの体内に送り込んで免疫を作らせるもので、ウイルスそのものを培養して材料にするワクチンとは違い、短期間で製造することが可能だとされます。
さらに長崎大学では、このワクチンを注射ではなく、極めて小さな微粒子にして口から吸い込むことで、肺の粘膜に効率よく送り届ける技術の開発を進めていて、副作用の少ない、より安全なワクチンを目指しています。
開発チームでは年内にも、マウスを使ってワクチンの性能を確かめる実験を行う予定です。
長崎大学大学院の佐々木均教授は「RNAを使ったワクチンが完成すれば、非常に迅速に製造することが可能になる。また、吸入式にすれば、医療体制が整っていない発展途上国などでも利用しやすいワクチンになるので、長崎大学が世界の新型コロナウイルス対策に貢献できるよう、開発を進めていきたい」と話しています。
世界のワクチン開発状況
WHO=世界保健機関によりますと、今月29日の時点で新型コロナウイルスのワクチンは、世界中で合わせて150近い開発計画が進められていて、このうち17のワクチンについては実際に人に接種して安全性や有効性を確かめる臨床試験が始まり、1つは多くの人で確かめる最終の第3段階に入っています。
最も進んでいるのはオックスフォード大学と、イギリスに本社がある製薬大手「アストラゼネカ」が開発を進めているワクチンです。
このワクチンは遺伝子技術を使って、新型コロナウイルスの一部を大量に作るもので、すでに臨床試験の第2段階までを終え、これまでに18歳から55歳までの、およそ1000人に接種しています。
このワクチンは今月、患者が多く出ているブラジルなどで、多くの人に投与する最終の第3段階に入りました。
また、中国の国営メディアは中国国内では、3つのワクチンが第2段階を終えたと伝えていて、今後、最終の第3段階に入るものとみられています。
このほか、アメリカの製薬企業「モデルナ」は、NIH=国立衛生研究所とともに開発を進めている、人工的に合成した遺伝子を使うワクチンについて来月には最終段階に進み、3万人に投与して安全性と有効性を確かめる計画を発表しています。
日本でもワクチンの供給について、アストラゼネカと協議を始めていますが、ワクチンが世界中に提供されるまでには時間がかり、各国の争奪戦になる懸念があります。
このため、WHOは発展途上国にも公平に分配するため、加盟国に資金提供を呼びかけています。
遺伝子ワクチンとは
ワクチンは、ウイルスの一部などを体内に入れることで、ウイルスを排除する抗体と呼ばれる、たんぱく質を作りだす免疫の働きを促すもので、事前に接種しておくことで感染や重症化を防ぎます。
これまでは毒性を弱めたり、無くしたりしたウイルスやその一部が使われてきましたが、ニワトリの卵や動物の細胞などを使って培養する必要があり、実際に培養できるかや、抗体ができるのを促す能力があるか、調べるのに時間がかかり、ワクチンが実用化されるまでに数年から10年程度の時間がかかるとされてきました。
新型コロナウイルスの感染拡大が世界中で止まらない中、こうした課題を解決できるのではないかと期待されているのが、より早いスピードでの開発が可能とされる新しいタイプのワクチン、「遺伝子ワクチン」です。
遺伝子ワクチンは、ウイルスの遺伝子の一部を人工的に作りだして接種することで、体内で抗体を作るよう促す、「抗原」と呼ばれるたんぱく質を作り出します。
抗原ができると、免疫の仕組みが反応し、ウイルスなどを排除する働きを持つ抗体が作られ、感染や重症化を防ぐことができると考えられています。
ウイルスそのものを使う必要がなく、遺伝子の情報が分かっていれば、そのウイルスの遺伝子の一部を人工的に合成して作って、増やすことができるため、従来の方法より早く開発できるとされ、新型コロナウイルスのワクチンで開発が先行しているものの多くは、このタイプのワクチンです。
ただ、遺伝子ワクチンはこれまでに実用化されたものはなく、遺伝子が人の遺伝子に組み込まれて予期せぬ影響が出ないかや、接種した際に、実際にウイルスを排除するのに有効な抗体を作り出すことができるかどうかわからないという課題もあり、確認する作業が世界中で進められています。
SARSでは実用化に至らず
ワクチンの研究開発は、新型コロナウイルスと同じコロナウイルスの一種による感染症で、2003年に中国やアジア各地を中心に感染が拡大したSARSでも進められましたが、実用化には至りませんでした。
SARSは最初の患者が確認されてから8か月後にはWHOが終息を宣言し、その後広がりませんでした。
このため、ワクチン開発は感染が拡大していた時期に、間に合わなかったのです。
日本国内でも長崎大学や東京都医学総合研究所を中心に研究開発が行われ、動物実験では一定の効果が確認されましたが、動物実験用のワクチンの作成までに1年ほどかかり、実際にヒトに接種して、安全性や有効性を確かめる臨床試験には至りませんでした。
ADEとは
新型コロナウイルスのワクチン開発への期待が高まるなか、安全性の観点から懸念されているのが、ADE=抗体依存性感染増強という現象です。
ADEは、ワクチンによって作られた抗体がウイルスと結び付いたときに無害化できず、かえって感染や増殖を促すなどして、症状を悪化させてしまう現象で、新型コロナウイルスのワクチンでも同様の現象が起きるおそれがあるのではないかと懸念されています。
ワクチンを接種することで不十分な抗体ができ、本来はウイルスなどを攻撃して分解する免疫細胞の一種、「マクロファージ」にウイルスが感染してしまうことで増殖につながると考えられています。
実際に、SARSやMERSといった過去のコロナウイルスのワクチン開発の過程では、動物実験でワクチンを接種すると、症状が悪化したケースがあったということです。
また、1960年代に行われた乳幼児に肺炎などを引き起こすRSウイルスのワクチンの臨床試験では、有効な抗体が作られなかっただけでなく、ワクチンを接種した後にRSウイルスに感染した際にかえって悪化し、死に至るケースもあったということです。
さらに、フランスの製薬企業が開発したデング熱のワクチンは、フィリピンで接種後にウイルスに感染した子どもが死亡したケースが報告されて接種が中止され、ADEが起きた可能性が指摘されています。
このため、新型コロナウイルスのワクチンでも、ADEが起きないか、慎重に確かめることが求められています。
ワクチンに詳しい東京都医学総合研究所の小原道法特任研究員は「ワクチンを接種した当初は強い抗体ができても次第に弱くなり、中途半端な抗体がかえって悪化させることがある。抗体ができれば良いのではなく、強い抗体が長続きすることが重要だ。ワクチン開発においては有効性とともに安全性を慎重に見極める必要がある」と話しています。
+++++++++++++++++++++++++++++
https://digital.asahi.com/articles/DA3S14513973.html?pn=3
(新型コロナ)ワクチン開発、今どんな状況? ウイルス使わないタイプに期待
朝日新聞2020年6月16日 5時00分
新型コロナウイルスの感染や重症化を「免疫」の働きで防ぐため、世界各国でさまざまなワクチンの開発が進んでいる。どのようなワクチンが研究されているのか。実用化が待ち望まれているのに、時間がかかるのはなぜなのか。
世界保健機関(WHO)によると、新型コロナウイルスのワクチンは130種類を超す研究が進み、すでに10種類がヒトで安全性や効果を調べる臨床研究の段階に入っている。
たとえば、ウイルスの毒性を弱めて体内に入れる「生ワクチン」や、感染性をなくしたウイルスやその一部を使う「不活化ワクチン」がある。生ワクチンは麻疹(はしか)など、不活化ワクチンはインフルエンザなどで実績があるワクチンだ。
ただ、こうした従来型ワクチンには課題もある。ウイルスそのものをワクチンの材料に使うため、ウイルスを培養して増やすのに長い時間がかかり、感染を防ぐため厳重に管理された設備も必要だ。
そこで、開発時間やコストを抑えられると期待されるのが、ウイルスそのものを材料に使わないタイプのワクチンだ。
遺伝子操作技術を使ってウイルスのたんぱく質を作り、ワクチンの材料に使う「遺伝子組み換えたんぱくワクチン」や、ウイルスの外見そっくりな「VLPワクチン」がある。
さらに新しいタイプのワクチンとして「遺伝子ワクチン」が開発されている。ウイルスの遺伝情報の一部だけを体内に入れることで、免疫反応を起こす。
遺伝子ワクチンは、日本では製薬企業アンジェスと大阪大学が動物実験を進めている。米バイオ企業のモデルナ社は、開発中の遺伝子ワクチンについて7月にも3万人規模の最終臨床試験を始めると発表した。
ワクチンに混ぜる「アジュバント(免疫補助剤)」という成分も注目される。アジュバントには免疫反応を強めたり、複雑な免疫反応を調整したりする働きがある。東京大医科学研究所の石井健教授は「アジュバントなど成分の組み合わせで、ワクチンの効果は大きく変わる」と話す。アジュバント研究はワクチン開発に欠かせないという。
米国は、ワクチン開発を加速させるため、「ワープ・スピード作戦」と名付けた計画に約1兆700億円をつぎこむ。きわめて異例だが、開発が成功するかわからないうちに、大量生産の準備を始める。「年末までに1億回分のワクチンを用意したい」とアンソニー・ファウチ米国立アレルギー感染症研究所長は、米医師会雑誌のインタビューで述べている。
ワクチンを開発した国は、自国で優先的に使うと予想され、各国が取り組みを加速させている。日本も2020年度補正予算にワクチン開発や生産ライン整備支援なども含め約2千億円を盛り込んだ。
■重症化の恐れある「ADE」、課題
新たなワクチン開発には通常10年かかるとも言われる。安全性を慎重に確認する必要があるためで、その中でも研究者が心配する大きな課題が「ADE(抗体依存性感染増強)」だ。
通常、ワクチンを接種すると、体内にウイルスを無力化する「抗体」ができ、発病や重症化を防ぐ。
だが、長崎大のモイ・メンリン教授によると、抗体がウイルスを無力化できないと、抗体がウイルスと免疫細胞をつなぐ架け橋のようになり、ウイルスが免疫細胞に入って増え、感染を強めることがある。これがADEだ。
蚊が運ぶデングウイルスがひきおこす「デング熱」のワクチンとADEの関係が疑われたことがある。フランスの製薬大手サノフィがデング熱ワクチンを開発。フィリピン政府が接種を大規模に進めたが、2017年に中止した。
中止されたのは、それまでデングウイルスに感染したことがない人が、ワクチン接種後に感染すると、重症化リスクがあると報告されたからだ。ワクチン後の重症化の原因はADEの可能性がある。
コロナウイルスには様々な種類があり、ADEと関係するウイルスもある。北里大の高野友美准教授によると、ネコに感染するコロナウイルスでADEが起こることが知られている。
パンデミック(世界的大流行)となった新型コロナウイルスがADEをひきおこすかどうかは、まだわかっていない。ただ、中国で開発された新型コロナウイルスの不活化ワクチンでは、サルの実験でADEはなかったと報告された。
長崎大のモイ教授は、ワクチンとADEについて「慎重に安全性を検証していく必要がある」と指摘している。
(引用終わり)