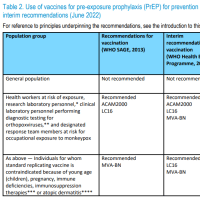
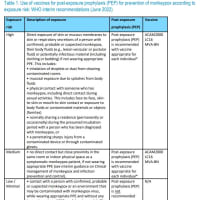
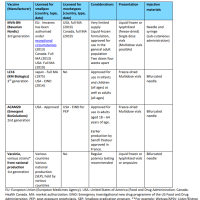
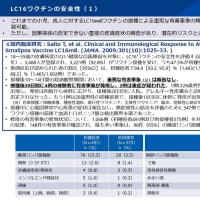
ブログの字数制限のため、2010年から記載しているワクチンごとの変遷についてを、予防接種の歴史から本ページに分離
一部の情報がアップデートされていない点を注意して下さい(2018.5)
種痘
- 1948年~1976年、法律による接種
- 1970年、国内で種痘化問題発生
- 1971年、英米で強制による種痘接種の中止
- 1976年~(現行)、法律による臨時接種(流行が起きた場合にのみ予防接種法に基づき接種)
- 1980年、根絶宣言により定期接種の廃止
BCG
- 1951年~1967年、法律による接種(皮内)小学校就学前の乳幼児を対象、毎年ツ半陽性以外なら接種
- 1967年~現在、法律による接種(経皮)
- 1974年6月~小学校就学前の乳幼児4歳までに定期、小学校・中学校で計3回、ツ半陰性なら接種
- 1982年、2回目の接種を中2から中1へ変更
- 1995年からツベルクリン反応9mm以下に接種へ変更
- 2003年4月~、小学生・中学生での接種を中止し、4歳未満のみの接種へ変更
- 2005年4月~、生後6月に達するまでの乳児(特別な理由があれば1歳まで)に対象を変更、事前のツ半実施を中止
- 2013年4月~(現行)、生後1歳に至るまでの乳児に対象を変更(標準的には生後5から8月で接種)
腸チフス・パラチフス、発疹チフス
- 1948年~1970年、法律による接種
- 患者数の減少と副反応の強さのため中止
コレラ
- 1948年~1994年に法律による接種(緊急)
三種混合(DPT)含有ワクチン
- 1948年~1950年、ジフテリア単独で法律による接種
- 1950年~1955年、百日咳単独で法律による接種
- 1953年~破傷風トキソイドが任意接種として使用可能に
- 1958年~1968年、二種混合ワクチン(DP)の法律による接種
- 1968年~1981年、三種混合ワクチン(DPT)の法律による接種(破傷風はヒト-ヒト感染しないため開始当時は予防接種法の基準を満たさなかったが、混合ワクチンとして追加された)
- 1972年~、二種混合ワクチン(DT)の生産開始
- 1974年~1975年4月に全菌体百日咳ワクチンによる副反応と考えられる死亡症例が2例岐阜と名古屋であり、百日咳ワクチンは一時見合わせ、原則個別接種へ移行(強制接種は継続)、接種時期の緩和・拡大(再開後も接種率上がらず、患者数増加)
- 1981年~現在、三種混合ワクチン(DTaP:DT沈降精製Pワクチン)の法律による接種(aはacellular: 無菌体or精製の意味)
- 1988年~、個別接種では低年齢で接種可
- 1995年~、接種対象者が1期初回:3-72月、1期追加:接種後12-18月に至る期間、2期:12歳に達する日の属する年度から、1期:生後3-90月、2期:11-13歳未満に変
- 2014年12月~、不活化ポリオワクチンを追加混合した4種混合ワクチン(DPT-IPV)製剤が定期接種の対象となって以降、接種者数が減少し、製薬企業が製造販売を中止することとした
- 2016年2月~、阪大微研が製造するDPTワクチン、トリビックの添付文書が一部変更承認され、思春期以降の追加接種が可能となった
- 2017年12月~、トリビックの添付文書が正式に改定された
- 2018年1月29日~、トリビックの販売が再開された
- 2023年3月27日、一般財団法人阪大微生物病研究会が開発した、DPT-IPV-Hibの5種混合ワクチン、ゴービックが承認される。
- 2023年9月25日、KMバイオロジクスが開発した、DPT-IPV-Hibの5種混合ワクチン、クイントバックが承認される。
ワイル病(レプトスピラ症)
- 1954年~1975年、流行地でのみの任意接種
- 1975年~1994年、法律による接種
- 1995年~現在、任意接種
日本脳炎
- 1954(5)年~1975年、推奨接種による任意接種(ネズミ脳細胞由来)
推奨接種:法定化されていないワクチンについて、予防接種法の枠外で任意接種の形をとるものの、自治体に対して、住民に接種の機会を提供し、その接種を推奨するよう指導するもの
(推奨接種は日本脳炎がヒト-ヒト感染しないため、1976年の改正まで予防接種法の基準に合致しなかったための措置)
(かつての予防接種法の基準は、人から人に感染するということ、発生状況(可能性)、疾病の重要性、予防接種の有効性・安全性の4点)
- 1966年~、高度精製ワクチンの使用
- 1967年~、特別対策による公的負担の導入「予防接種事故に関する責任の所在について」(公衆衛生局防疫課長通知)
- 1976年~1995年、定期接種(一般臨時)
- 1988年~、北京株1回0.5mlに変更
- 1995年~、一般的な臨時接種の廃止、接種義務→努力義務による接種(法の改正は1994年)
- 2005年5月26日、厚生労働省 疾病・障害認定審査会において、ADEMとワクチンの因果関係を事実上認定
- 2005年5月30日、「定期の予防接種における日本脳炎ワクチン接種の積極的勧奨の差し控えについて(勧告)」健康局結核感染症課長通知発出
- 2005年7月29日、第三期(14歳~16歳未満)定期接種の廃止
- 2009年2月、ベロ細胞由来の乾燥細胞培養日本脳炎ワクチンを製造販売承認
- 2009年6月2日、乾燥細胞培養日本脳炎ワクチンを定期接種に導入
- 2010年4月1日、積極的勧奨を順次再開
- 2011年5月20日、予防接種法施行令の一部を改正(平成7年6月1日生まれ~平成18年3月31日生まれの者について、20歳未満まで定期接種対象とする)
ポリオ
- 1960年8月~1964年、急性灰白髄炎緊急対策要綱(定期接種・臨時接種・任意接種を規定、低所得者に予備費からの公費負担実施)による不活化ワクチンの推奨接種(公費負担された初めての予防接種法に規定のないワクチン)
- 1961年1月、不活化ワクチンの定期接種開始(生後6か月~1歳6ヵ月を対象)
- 1961年3月28日、法の一部改正により対象疾患に急性灰白髄炎が追加される
- 1961年6月20日、流行性生ワクチン緊急接種(12歳までの全員)を決定
- 1961年9月、急性灰白髄炎特別対策要綱によるポリオ生ワクチンの公費負担実施
- 1964年~現在、生ワクチンの法律による接種(1976年~定期、対象は生後3-48月、1995年以降は生後3-90月)
- 1980年、ドロッパー法へ変更
- 2012年9月、不活化ワクチンの定期接種を開始
- 2012年11月~(現行)、DPT-IPVの4種混合ワクチンの定期接種を開始
麻疹
- 1966年~1969年、KL法(不活化 killed vaccine後に生ワクチン live vaccineを接種)による接種(四肢末端に強い発疹、肺炎と胸膜炎の合併、カタル症状が乏しいなどを臨床的特徴とする異型麻疹の発生が問題となること、Kワクチンを先に接種することによりLワクチンによる抗体獲得が見られない場合があり得ることなどから、KLの併用方式は中止となった[IDSC 予防接種の話])
- 1969年~1978年、FL法(麻疹弱毒生ワクチンfurther attenuated live vaccine)による接種
1976年6月に予防接種法改正で定期接種に位置づけ
- 1978年10月~2006年、法律による接種(原則として個別接種、対象は生後12-72月、1995年4月以降は生後12-90月)
- 2006年4月~、法律による2回接種(MRワクチンとして、対象は生後12-24月と就学前の1年間)
- 2008年4月~2013年3月時限措置として13歳相当(3期)、18歳相当(4期)に2回目の接種
(2011年5月20日~2012年3月まで海外に修学旅行を予定する17歳相当でも2期接種可とされた)
- 2015年3月27日、世界保健機関西太平洋地域事務局により日本が麻しんの排除状態にあることが確認された(厚生労働省プレスリリース)。
風疹
- 1977年8月~1995年3月、中学生女子を対象として法律による接種
- 1995年4月~2006年3月、生後12ヶ月後から90ヶ月(標準として36ヶ月まで)の幼児を対象として法律による接種
- 1995年4月~2011年10月経過措置として中学生男女を対象として1回接種
- 1999年4月、先天性風疹症候群の全数把握を開始
- 2001年11月7日~2003年9月30日時限措置として1979年4月2日~1987年10月1日生まれの接種歴のない男女
- 2006年4月~、法律による2回接種(MRワクチンとして生後12~24ヶ月+就学前の1年間)
- 2008年1月~、風疹の全数把握(7日以内)を開始
- 2008年4月~2013年3月時限措置として13歳相当(3期)、18歳(4期)相当に2回目の接種
(2011年5月20日~2012年3月まで海外に修学旅行を予定する17歳相当でも2期接種可とされた)
- 2018年1月~原則24時間以内の報告対象疾患+全数遺伝子検査
- 2019年2月~2022年3月、昭和37年4月2日から昭和54年4月1日までの間に生まれた男性が風しんに係る定期の予防接種の対象者として追加された(5期接種)
ムンプス
- 1983年~現在、任意接種
MMR(麻疹・ムンプス・風疹)
- 1989年4月~1993年4月、定期接種の麻疹に替えて希望者に接種(阪大微研の薬事法違反及び無菌性髄膜炎発生に関する調査のため中止)
対象は生後12-72月(標準的には母体からの移行抗体を考慮して生後18-36月)
乾燥弱毒生麻しんおたふくかぜ風しん混合ワクチンの接種について(通知)
1993年4月27日健医感発第51号疾病対策課結核感染症対策室長通知にてMMRの使用は当面見合わせることとされる
1993年5月、阪大微研の薬事法違反(製造方法の変更が未承認等)を確認、1994年2月、同社を薬事法違反で行政処分(第3回予防接種基本方針部会資料)。
MR(麻疹・風疹)
- 2005年認可、2006年~現在、法律による接種(2回接種法)
B型肝炎
- 1985年~現在、母子衛生施策による接種
- 1986年~、母子感染防止事業開始
- 1988年~、組み替え沈降ワクチン
- 2016年10月~、定期接種化
A型肝炎
- 1995年~現在、任意接種
- 2013年3月~、エイムゲンの使用適応が16歳未満の小児(主に1歳以上)へも拡大された
水痘
- 1987年~2014年9月、任意接種
- 2014年9月~(現行)、定期接種を開始
帯状疱疹
- 2016年3月18日、水痘ワクチンに50歳以上の帯状疱疹予防の効能を追加する一変承認
- 2016年6月22日、帯状疱疹ワクチンの定期接種化について審議を開始
- 不活化組換え帯状疱疹ワクチン、シングリックスが2018年3月23日、国内での製造販売承認を取得
- 2020年1月29日に国内で発売
狂犬病
- 1980年~現在、組織培養不活化ワクチンの任意接種
- 2019年2月22日、GSKのラビピュール筋注用(乾燥組織培養不活化狂犬病ワクチン)が「狂犬病の予防及び発病防止」を効能・効果として製造販売承認の方向で審議会の了承を得る。
再審査期間8年。海外では74の国・地域で承認済み。
高齢者肺炎球菌(23価)
- 1988年~2014年9月、任意接種
- 2014年9月~定期接種
結合型肺炎球菌(7価・13価・15価)
- 2000年、PCV7が海外で承認
- 2008年、PCV10が海外で承認
- 2009年10月16日、PCV7が国内で承認
- 2009年、PCV13が海外で承認
- 2010年11月26日~ワクチン接種緊急促進基金事業によりPCV7を原則無料で(任意)接種
- 2013年4月~PCV7が定期接種年
- 2013年6月18日、日本でPCV13が承認
- 2013年11月~定期接種をPCV7からPCV13に変更
- 2015年3月26日、PCV10が国内で承認
- 2022年9月26日、MSDが開発した15価肺炎球菌ワクチン、バクニュバンスが承認される。
インフルエンザ
- 1948(S23)年 予防接種法制定(対象疾病にインフルエンザも記載あり。実施規定は無し)
- 1953(S28)年 インフルエンザ予防接種施行心得制定(事務次官通知)
- 1954(S29)年 インフルエンザ防疫実施要領(局長通知)
- 1957(S32)年 推奨任意接種(1962年まで特別対策による公的負担なし:1961年の緊急灰白髄炎特別対策要綱の応用)
- 1962(S37)年 インフルエンザ予防特別対策(局長通知)
勧奨の対象「小学校、中学校、幼稚園及び保育所の児童」
(1976(S51)年の予防接種法改正まで、法律に基づかず行政指導による勧奨接種としてインフルエンザ予防接種を実施。低所得者以外は実費徴収を記載)
- 1972(S47)年 HAワクチンへ切り替え
- 1976(S51)年 一般的な臨時の予防接種として予防接種法に基づき実施されるようになる
都道府県知事が、予防接種を受けるべき者の範囲及び期日を指定
(通知において、「保育所、幼稚園の生徒、小中学生を対象に実施すること」「必要があれば高校生も対象として差し支えないこと」「3歳未満の乳幼児については特別な場合を除き実施しないこと」とされていた。)
- 1987(S62)年 公衆衛生審議会伝染病予防部会意見 「インフルエンザ予防接種の当面のあり方について」
現在の不活化ワクチンを用いた予防接種では、社会全体における流行防止の効果について判断できるほどの研究データは十分に存在しないが、個人の発病防止効果や重症化防止効果は認められるため、個人が自発的意思に基づいて予防接種を受けることが望ましく、実施者は被接種者及び保護者の意向に十分配慮すべきである。
- 1993(H5)年 公衆衛生審議会答申 「今後の予防接種制度の在り方について」
現在、一般的な臨時接種の対象となっているインフルエンザについては、当審議会において、社会全体の流行を抑止することを判断できるほどの研究データは十分に存在しない旨の意見をすでに提出しており、また、流行するウイルスの型が捉えがたく、このためワクチンの構成成分の決定が困難であるという特殊性を有すること等にかんがみ、予防接種制度の対象から除外することが適当である。
- 1994(H6)年 予防接種法の改正 「予防接種法の対象疾病から、インフルエンザを削除」
平成11年 公衆衛生審議会感染症部会予防接種問題検討小委員会報告書
個人の発病防止・重症化防止を主な目的として、高齢者を対象としたインフルエンザワクチンを予防接種法に基づく予防接種として実施していくことについては、具体的な検討を早急に進めていくことを提言。
(小児等のインフルエンザについては、有効性等についての調査研究が不十分であることから、本委員会としては、今後、小児等のインフルエンザに関する有効正等に関する調査研究を行い、その結果に基づいて対応を検討することを提言)
(現行の不活化ワクチン接種によって、社会全体の流行を阻止し得ることを積極的に肯定する研究データは十分に存在しないため:予防接種に関する検討会 中間報告書)
- 2001(H13)年 予防接種法の改正
「二類疾病」を新設し、高齢者へのインフルエンザ予防接種を導入
高齢者等に接種した場合の発症防止・重症化防止効果が確認されたことから65歳以上では公費負担(B類疾病なので3割程度)
- 2011年10月~、小児の接種用量が生後6月以上3歳未満は0.25mL、3歳以上が0.5mLに変更
(2010年シーズンまで、1歳未満0.1mL、1歳以上6歳未満0.2mL、6歳以上13歳未満0.3mL、13歳以上0.5mL)
同様に接種回数も、13歳以上は1回または2回接種が追加
Hib インフルエンザ桿菌
- 2007年認可、2008年~現在、任意接種
- 2010年11月26日~ワクチン接種緊急促進基金事業によ原則無料で(任意)接種
- 2013年4月~(現行)、定期接種として使用
HPV
- 2009年12月22日2価HPVワクチン発売
- 2010年11月26日~ワクチン接種緊急促進基金事業により2価HPVワクチンを中学1年生~高校1年生の女子に原則無料で(任意)接種
- 2011年8月26日4価HPVワクチン発売
- 2011年9月15日~4価HPVワクチンをワクチン接種緊急促進基金事業の対象に追加
- 2013年4月~2価・4価HPVが定期接種
- 2013年6月14日~積極的干渉を差し控え
- 2020年7月21日、9価HPVワクチンが国内承認される
- 2020年10月9日、積極的勧奨差し控えを維持しつつも、個別通知を再開できるとの通知を発出
- 2021年11月12日、審議会が積極的勧奨の再開を承認
- 2021年11月26日、積極的勧奨を再開
ロタウイルス
- 2011年11月21日1価ヒトロタウイルスワクチン(ロタリックス)発売
- 2012年7月20日5価ウシロタウイルスワクチン(ロタテック)発売
~現在、任意接種
髄膜炎菌
- 2014年7月 4日、ACWY135の4価結合型ワクチン<MCV4>(メナクトラ)が製造販売承認
- 2015年2月24日、MCV4が健保等一部限定適用(ラブリズマブ及びエクリズマブの使用予定者・使用中の場合にのみ適用、20194円/瓶)
- 2015年5月18日、MCV4が発売開始
- 2022年9月26日、サノフィが、メナクトラから抗原量を4→10μgに増量して、結合蛋白を破傷風トキソイドに変更して開発して4価髄膜炎菌ワクチン、メンクアッドフィが承認される。
黄熱
- 1937年に米国で開発
- 1951年に国際衛生規則(ISR: International Sanitary Regulation)制定
- 1951年に公布された検疫法によって黄熱は検疫伝染病(現検疫感染症)と規定される
(注:現在の検疫法では規定されていない)
- 1953年に国内での予防接種が開始される
- 1969年に国際保健規則(IHR(2005))制定
- 2018年11月~5ドーズバイアルの製造販売中止に伴いワクチンの枯渇(接種中止)
欧州で製造されているStamarilによる特定臨床研究を開始(jRCT)
- 2019年6月10日、黄熱ワクチン1人用ワクチンが承認される。
Reference: 厚労省検討会資料(H16), 過去の予防接種法の改正について, 他
更新履歴:
DPTワクチンの情報更新(2018.5)
黄熱ワクチン・各ワクチンページへのリンク等の情報更新(2018.11)
帯状疱疹の記載を追加(2019.01)
新たに承認された狂犬病ワクチンの記載を追加(2019.02)