既述のページへのリンク: ①炭素という名称の起源 ②炭素の認識:木炭は何故炭素なのか ③元素としての炭素の性質 ④炭素の誕生 ⑤宇宙の炭素 ⑥原始太陽系の炭素 ⑦炭素と有機物 ⑧炭素原子とメタン分子 ⑨炭化水素分子内での炭素の結合 ➉分子内での炭素と酸素の共有結合 ⑪窒素の形成と水素と炭素と酸素 ⑫窒素を含んだ有機化合物と無機化合物 ⑬星(恒星)と炭素 ⑭炭化水素分子内での炭素―炭素結合と電子 ⑮複雑な構造の炭化水素、⑯複素環式化合物、⑰炭素化合物の多様性、⑱炭素原子と星間分子
ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー
炭素化合物が他の元素の化合物と区別される特徴として下記の項目があげられる。
① 炭素化合物の数が非常に多いこと、そしてこれらの化合物が巨大なまた複雑な分子として存在できること。
② 炭素原子は他の元素では不可能なほど互いに結合しあえる。炭素原子は結合しあって、幾千原子もの長さの鎖や、あらゆる大きさの環を作ることがでる。これらの鎖や環には、枝分かれや橋渡しがあってもかまわない。炭素だけで形成された分子のフラーレンを例外として、鎖や環を形成している炭素原子には、他の元素が結合している。おもに水素であるが、フッ素、塩素、臭素、酸素、窒素、硫黄、リンなどのこともある。
③ 構成原子が同じでも原子配置が違えば、それに対応してそれぞれ一つの化合物が存在し、その数は膨大なものとなる。そしてそれぞれの化合物が、その化合物に固有な一連の化学的及び物理的性質を持っている。
共有結合は炭素化合物で見られる基本的な結合様式で、結合力のもとは静電的な引力であり、結合に関与している各電子と原子核の間に引力が働く。分子を形成する前の単独の原子には固有の数の電子が存在し、それぞれの電子は原子核の周りに固有の確率で分布する。その分布の状態を原子軌道と呼ぶ。原子軌道は原子核を囲む殻(電子殻)に分かれていて、内側の殻から順に、1,2,3の番号が付けられ、各殻はさらに副軌道に分かれ、s、p、d、・・・の記号が付けられている。従って、原子軌道にはエネルギー順位の低い順に1s、2s、2p、3s、3p、3d、・・・と呼ばれる軌道が存在する。s軌道は原子核を中心とした球形をしていて、2s軌道は1s軌道より大きく、3s軌道は2s軌道よりさらに大きい。2s軌道に存在する電子が1s軌道に存在する電子よりエネルギーが高く(より不安定)なるのは、電子と核の間の平均距離が増大したため、静電引力が減少するからである。
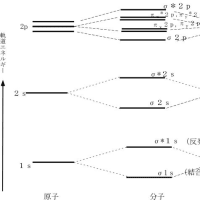
原子内の電子配置を決める基本的法則に“Pauliの排他原理”がある。その原理とは「どの原子軌道にも電子は2個まで入ることができるが、2個の電子のスピンは互いに逆符号でなければならない」というものである。スピンが同符号である電子は、互いにできるだけ遠くに離れて存在しようとする傾向がある。ある軌道に電子が入り始めるのは、その軌道よりエネルギーが低い軌道が電子で満たされた後であり、ある軌道が1対の電子で満たされるのは、その軌道とエネルギーが等しい全ての軌道に、電子が1個ずつ入って初めて起こる。2p軌道は直交した三つのエネルギーの等しい軌道(2px、2py、2pz)で形成されているが、それぞれの軌道に1個ずつ電子が入ってから次の電子がそれぞれの2p軌道に入っていく。周期表の第一周期と第二周期の元素の原子軌道における電子配置を下図に示す。ただし、○は原子軌道、↑は原子軌道に存在する電子とそのスピンの符号を表す。

分子にも原子と同じように電子軌道(分子軌道と呼ぶ)があって、そこに電子が入いる。この軌道も原子軌道とほぼ同じ法則に従う。分子軌道の中心には、多数の核があって、軌道は分子全体を覆っていると考えられる。核と電子の分布はただ一つで、分子が最も安定な状態に対応するものである。複雑な数式で構成される分子軌道を直接計算で求めるのは非常に困難なため、普通は次の二つの仮定を設ける。1) 各電子対は、実際上ただ2個の核の近くにのみ、ほとんど局在している。2) これらの局在化した分子軌道の配置は、分子を構成している原子軌道の形と配置に単純な形で結びついている。ここで設けられた仮定の「局在化した分子軌道(結合軌道)」の考え方は、古典的な分子内での結合の考え方と共通点が多い。ベンゼンのように一つの古典的な構造式では表現しきれない例外的な分子には、局在化分子軌道法も適用できないが、共鳴構造式のように古典的な構造式で近似的に表現する方法(共鳴理論)が考案されている。
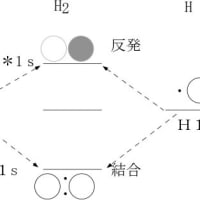
離れた位置に孤立して存在する原子が偶然一緒になって分子を形成する過程は、宇宙における物質形成の極初期から起こった。水素原子と水素原子が結合して水素分子が形成されたのがそれである。原子の基本的結合様式の一つである共有結合が形成されるには、原子2個が互いに原子軌道を重ね合うように位置する必要がある。この原子軌道に電子が1個ずつ入っていると2個の原子軌道が合体して1個の結合軌道ができる。この結合軌道に入っている2個の電子はスピンが逆符号になっている必要がある。各電子は結合軌道全体に広がっており両方の原子核に属していることになる。電子と原子核がこのような配置をとると、個々の原子に電子が配置されている場合よりエネルギーが低い(安定な)状態となる。従って、分子を最も安定にするには、原子間の結合を最も強くすることである。そのために、本来の原子軌道を変形(線形結合)して、結合に関与する電子の数を増やし、かつ原子軌道の方向性を結合方向に強めた軌道(混成軌道と呼ぶ)が形成される。
第1周期の元素の場合、一つしか軌道(1s軌道)しか存在しないので、原子軌道に電子が電子対として存在するヘリウム(He)は、それ以上に電子を収納できないため、他の原子と共有結合を形成することができない。しかし、第2周期の元素の場合、2s軌道の電子が電子対として存在して本来は結合に関与できない場合でも、2p軌道に空の軌道があれば2s軌道の電子の1個を少しだけエネルギーの高い2p軌道に移す(昇位する)ことによって結合に関与する不対電子を2個増やすことができる。この状態は、もとになった個々の原子軌道よりエネルギー的には高くなるが、分子を形成することによってこの不利は十分に克服される。
炭素の原子軌道には下図の左に示すように、1s軌道に2個、2s軌道に2個、二つの2p軌道に1個ずつ電子が入っていて、一つの2p軌道が空になっている。このままでは2p軌道の2個の不対電子のみ結合形成に関与して、結果として2本の結合しか形成できないことになる。もし2s軌道の電子の1個が同じ殻にある2p軌道に移る(昇位する)ことができれば4個の不対電子ができて、4本の結合形成が可能になり、より安定な分子を形成することができる。

原子間で結合を形成する時には、外郭電子の軌道を線形結合して形成される混成軌道を使用する。このことによって共有結合をする原子間の軌道の重なりをより大きくし、結合をより強くする。これと同時に共有結合の方向性も制限を受けることになる。炭素の場合、下図に示すように、三種の混成軌道(sp混成軌道、sp2混成軌道およびsp3混成軌道)による結合が形成可能である。sp混成軌道の場合には、混成軌道にある2個の電子が2本のσ結合作り、残りの2個の電子は元の2p軌道に不対電子として存在して2本のπ結合を形成する。sp2混成軌道の場合には、混成軌道にある3個の不対電子が3本のσ結合を作り、残りの1個の電子が元の2p軌道に不対電子として存在して1本のπ結合を形成する。sp3混成軌道では全ての電子が混成軌道に存在し結果として4本のσ結合を形成する。

2個の炭素が結合し、残りの結合相手が全て水素(炭化水素)の場合、sp混成軌道を使用した分子がアセチレン(C2H2)、sp2混成軌道を使用したのがエチレン(C2H4)、sp3混成軌道を使用したのがエタン(C2H6)である。これらの分子モデルを下図に示す。アセチレンは直線的で、エチレンは平面的、エタンは3次元的構造をしている。下の段に上のモデルを炭素―炭素結合の中心を軸にして90度回転したものも示した。

炭素がsp混成軌道を構成するとsp軌道には2個の不対電子が存在し、最初から存在する二つのp軌道が不対電子を持ってそのまま残ることになる。sp混成軌道に存在する2個の不対電子は、お互いに最も離れて位置するために中心原子の原子核を挟んで正反対に位置する。そのため、これらの電子によって形成されるσ結合で結ばれる原子は1直線上に配置されることになる。残りの二つのp軌道にある電子は、sp混成軌道で結ばれた炭素の間でp軌道どうしの側面の重なりによりπ結合を二本作ることになる。結果として炭素は1本のσ結合と2本のπ結合の3本の結合で結ばれたことになり、一般的にはこの結合を三重結合と呼ぶ。三重結合を持った炭化水素全般をアルキンと呼ぶ。ただし、実際のπ電子はp軌道で結ばれた2本のπ軌道ではなくて、σ結合を軸とした円筒状の軌道に分布する。三重結合の両側に結合している原子は距離的に離れているため立体的反発などの相互作用することは無い。従って鎖状の炭化水素分子の中に安定な構造として組み込むことができる。炭素―炭素結合の中で三重結合は最も強い結合で、最も反応性に富んでいる。
sp2混成軌道には3個の不対電子が存在し、それらが最も離れて存在しようとすると、原子核を中心に置いた正三角形の各頂点に電子が位置することになる。従ってsp2混成軌道を持った炭素原子は原子核から平面上に相互に120度の角度を持った3本のσ結合手が伸びることになる。炭素がsp2混成軌道を形成した場合には、残りの1個の電子は炭素原子本来のp軌道にそのまま残る。炭素と炭素がsp2混成軌道を使って結合を作る場合には1本のσ結合の他に、残されたp軌道の重なりで1本のπ結合ができる。その結果、炭素は2本の結合で結ばれたことになるので、その結合を二重結合と称し、二重結合を持った炭化水素を一般名称でアルケンと呼ぶ。
アルケンの一番簡単なものがエチレンである。この場合のp軌道の方向性を維持したπ結合の存在で炭素―炭素結合を軸とした回転はできなくなっている。そのため、二重結合の両側の水素が他の元素やグループ(置換基)に置換された場合、たとえ分子式が同じで、置換基も同じであっても異なった化合物(幾何異性体:トランス体とシス体)を形成する場合がある。下図にC4H8の分子式を持つ炭化水素の例を示した。この場合、二重結合を挟んだ置換基の反発のためシス体がトランス体より不安定になる。炭素鎖が長い分子には、適当に配置されれば、複数の二重結合が安定に存在することが可能となり、そのことも炭素化合物の種類を増やしている。
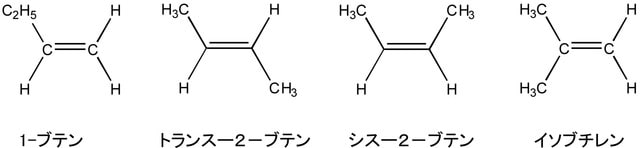
二重結合における置換基の配置についてトランスおよびシスで表現できない場合が非常に多くあるので、構造を示すための一般的規則が定められている。すなわち、原子および置換基に優先順位をつける規則(Cahn-Ingold-Prelogの順位則)があるので、それに従って二重結合を形成している炭素のそれぞれについて置換基の優先順位を決め、順位の高い方の置換基が分子の同じ側にあるか反対側にあるかをZ(同じ側)およびE(反対側)の記号を用いて表現する。下に例を示す。ただし、(置換基1)>(置換基2)は置換基1が置換基2より優先順位が高いことを意味する。

二重結合を含んでいると炭化水素でも結合に小さな極性を生じる可能性があり、結果として分子に小さな双極子モーメント生じる場合がある。それらの例を以下に示すが、矢印はアルキル基が二重結合の炭素に弱いながら電子を放出していることを意味している。しかし、通常の条件で分子としての安定性を損なうほどにはならない。以下の図では双極子を![]() で表し、矢印は正から負へ向いている。分子の持つ双極子モーメント(μ)の大きさ(D:デバイ)は電荷と電荷の中心間の距離の積で表され、分子の極性の目安となる。
で表し、矢印は正から負へ向いている。分子の持つ双極子モーメント(μ)の大きさ(D:デバイ)は電荷と電荷の中心間の距離の積で表され、分子の極性の目安となる。

炭素がsp2混成軌道を主体として形成する分子の特殊な例として、ベンゼンに代表される芳香族化合物と呼ばれる一群の環状化合物がある。芳香族分子の特徴は、π電子で結ばれた炭素が平面的環状構造を作り、その環が特別に安定になっていて、分子として特異な反応性を持っていることである。この特徴は、sp2混成軌道持った炭素に存在するp軌道の不対電子を主体として、非局在化した環状π電子雲が形成され、その電子の数が(4n+2)個の場合に現れる(Hückel則)。芳香族化合物にはベンゼン系芳香族化合物、複素芳香族化合物、非ベンゼン系芳香族化合物があり、以下にその例を示す。
ベンゼン系芳香族化合物
複素芳香族化合物
非ベンゼン系芳香族化合物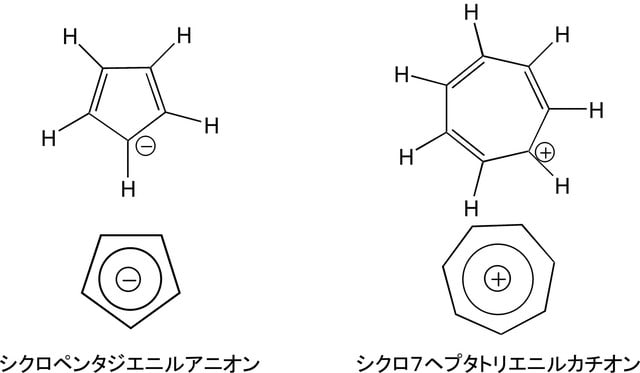
炭素のsp3混成軌道には外殻にある4個の電子が全て不対電子として含まれており、それらの電子が相互に最も離れて位置しようとすると、原子核を中心とした正四面体の頂点に位置する。結果として炭素の原子核から正四面体の頂点に向かって4本のσ結合手が伸びることになる。sp3混成軌道のみで組み立てられた炭化水素を飽和炭化水素と呼び、一般名はアルカンである。
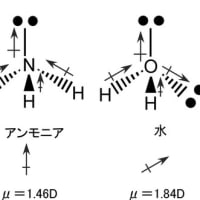
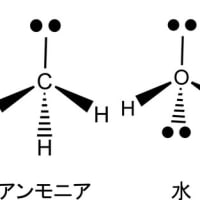
1個の炭素がsp3混成軌道によって水素と結合してできる分子がメタン(CH4)である。炭素と同じ第二周期の原子である窒素や酸素もsp3混成軌道によって水素と結合し、それぞれアンモニア(NH3)や水(H2O)の分子を形成する。その場合の電子の配置は下図のようになっている。結合に関与できる不対電子は窒素で3個、酸素で2個である。結合に関与しない電子対(孤立電子対又は非共有電子対と呼ぶ)が窒素では一つ、酸素では二つ存在する。メタンもアンモニアも水も互いに類似の構造をしているが、孤立電子対の性質ため3次元構造にいささかの差異があり、物理的性質や反応性は大幅に異なっている。
メタン、アンモニア、水の分子について孤立電子対を含めて立体構造で示すと下図のようになる(ーは紙面上の結合、![]() は紙面の前面へ向かった結合、
は紙面の前面へ向かった結合、![]() は紙面の背面へ向かった結合、孤立電子対は
は紙面の背面へ向かった結合、孤立電子対は![]() で、示してある)。その下に分子モデルを示してあるが、結合に関与しない孤立電子対は示してない。
で、示してある)。その下に分子モデルを示してあるが、結合に関与しない孤立電子対は示してない。


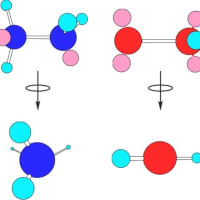
炭素2個のアルカンは エタン(C2H6)である。エタンと同様に2個のsp3窒素と水素で作られる分子がヒドラジン(N2H4)であり、2個のsp3酸素と水素で作られる分子が過酸化水素(H2O2)である。ここでエタンの炭素もヒドラジンの窒素も過酸化水素の酸素もsp3の混成軌道使い、σ結合によって結ばれているにも関わらず、物理的性質だけでなく反応性にも大きな違いができてくる。通常の環境ではヒドラジンと過酸化水素は不安定で、ヒドラジンは強い還元剤、過酸化水素は強い酸化剤として働くのに対して、エタンは安定で、それ自身では通常の環境でほとんど反応性を示さない。
エタンとヒドラジンと過酸化水素について孤立電子対を含めた構造式を下図に示した。炭素どうし、窒素どうし、酸素どうしの結合(σ結合)は、障害物が無ければ、結合を軸にして自由な回転が可能である。しかし、直接結合していない水素どうし、孤立電子対どうし、水素と孤立電子対は相互に反発するため回転の障害となる。そこで、この結合を軸として回転させた場合のそれらの化合物の最も安定な形(立体構造)を計算によって推定した分子モデルを構造式の下に示した。このモデルから原子間の反発だけでなく、孤立電子対の有無が分子の立体的構造に大きく影響していることが分かる。なお、この分子モデルでは、結合軸を水平にして横から見た図(孤立電子対がピンク色の球で表されている)とそれらのモデルを水平に保ったまま結合軸の中央で90度回転させた図(孤立電子対は省略してある)が示してある。

これらの分子の反応性の違いに大きく影響している要素としては、孤立電子対の存在の他に、元素によって電子を引き付ける力に差があることがある。異なった原子が共有結合した場合には、これらの原子は同じ電子雲に覆われていることになる。ただ、ほとんどの場合で結合している原子核の周りの電子雲の密度は異なっている。そのため、共有結合が正と負の極性を示すようになる。原子が電子を引き付ける度合いを電気陰性度と言う。異なった原子が共有結合を作るとき電気陰性度の差が大きいほど結合の極性は大きくなる。その結果としてその結合の反応性も高くなる。通常の有機化合物に良く登場する元素の電気陰性度は以下のような順になる。
F>O>Cl,N>Br>C,H
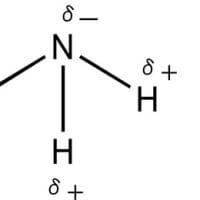
共有結合で結ばれた分子内の結合は電気陰性度の大きな原子の周りに電子が多く存在し、結果として結合に極性が生じる。炭素と水素は電気陰性度に殆ど差が無くてメタンの場合は炭素と水素の結合の間に殆ど電荷の偏り(分極)は起こらない。これに対してアンモニアや水の場合には窒素と水素の結合や酸素と水素の結合に分極が起こる。水の場合には酸素の電気陰性度が窒素の電気陰性度より大きいため、アンモニアより大きな分極を示す。分子内の結合の部分的な正(+)および負(-)の電荷を示すのにδ+およびδ―の記号を用いる。この記号を使ってアンモニアと水の分子構造を表すと下図のようになる。

結合の極性は結合の集合体としての分子に極性を作りだす。その結果は分子の物理的性質(沸点・融点・溶解度)を左右する。さらに、結合の極性は、その結合で起きる反応の種類を決めると同時に近くに存在する結合の反応にも影響する。分子の中で正と負の電荷の中心がずれていると、大きさが同じで符号が反対の一対の双極子を形成する。分子の持つ双極子モーメントの大きさは電荷の大きさと電荷の中心間の距離の積で表され、分子の極性の目安となる。メタンとアンモニアと水の双極子モーメントの測定値は、それぞれ0D(D:デバイ)、1.46D、1.84Dである。これらの双極子モーメントには、孤立電子対(非共有電子対)の存在が大きく影響している。以下の図では双極子を ![]() で表し、矢印は正から負へ向いている。
で表し、矢印は正から負へ向いている。
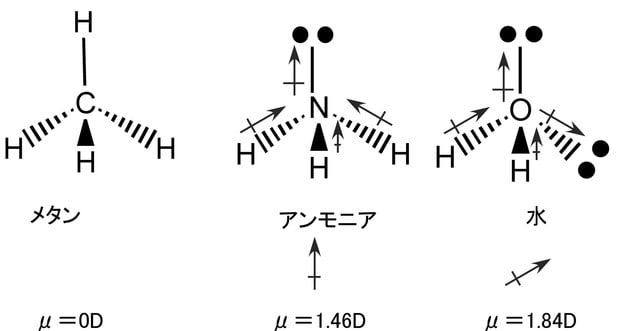
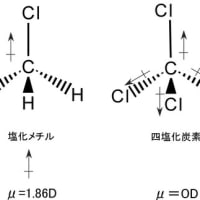
メタンの場合には、炭素と水素の電気陰性度がほぼ同じで、炭素―水素の各結合には双極子がほとんど生じないので分子全体の双極子モーメントも生じない。そのため、反応性に乏しく安定に存在する。電気陰性度が異なった原子が結合している場合にはその間の結合には双極子が生じるが、分子としての双極子モーメントには分子の立体構造が大きく影響する。下図に示すように塩化メチルの場合、炭素と水素の結合に双極子は生じないが、塩素と炭素の結合で電気陰性度の大きな塩素が負、小さな炭素が正に分極して双極子を生じ、その結合が分子全体の双極子モーメントを生み出している。一方、四塩化炭素の場合には、一本ずつの結合については双極子が存在するが、分子全体では各結合の双極子が打ち消し合って分子としての双極子モーメントは0Dとなる。

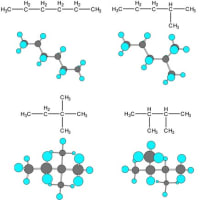
炭素は2s軌道にある2個の電子のうちの1個を2p軌道に1個ある空の軌道に昇位させることによって孤立電子対が存在しない状態にして、全ての外殻電子を分子形成のための結合に使える。2個の炭素を含んだ飽和炭化水素はエタンで、全ての結合に分極は無く、分子に双極子モーメントはない。このことは、3個以上の炭素が直線状に結合した場合でも、枝分かれして結合した場合でも、成り立つので、全ての飽和炭化水素(アルカン)が反応性に乏しく安定で、結果として無数の飽和炭化水素が安定に存在することになる。さらに、隣り合った炭素に結合した元素どうしの反発は、炭素―炭素結合を軸とした回転によって殆ど解除されるため、分子の大きさにかかわらず全体が安定になる形(立体配座:コンホメーション)を取ることができる。以下にC6H14の例を平面構造とモデルで示す。炭素が一つ増えるだけで形成可能な分子の種類は急速に増加するが分子としての安定性は保たれる。
C6H14

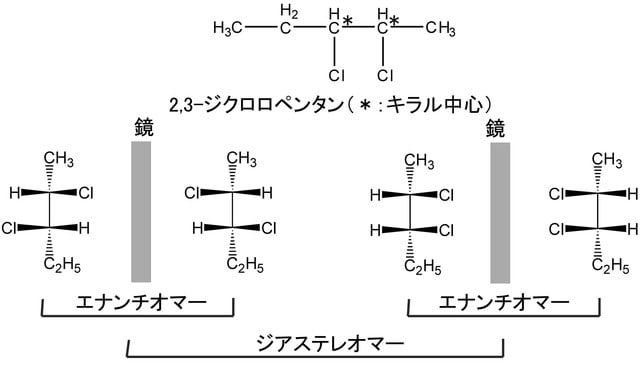
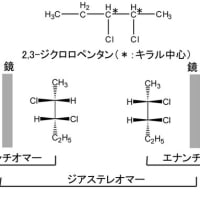
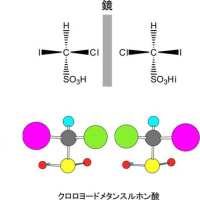
炭素がsp3混成軌道を持った場合には、分子式も構造式も同じであるのに、異なった化合物と認識される場合がある。これは、一つの炭素に結合した四つの原子又は原子団(置換基)が全て異なっている場合である。この場合には、この分子を鏡に映してできる3次元像に相当する分子が、どのように動かしても元の分子と重ねることができないので、明らかに立体的異性体関係にあると認識される(実像と鏡像が重ならない現象を一般的用語でキラリティーという)。このような異性体をエナンチオマー(鏡像異性体)と呼ぶ。下にその例を示す。この異性体は旋光性のみ異なっているので光学異性体といわれることもあるが、この言葉は定義が曖昧なため鏡像異性体に限定する場合には使わない。エナンチオマーの原因となっている炭素原子を不斉中心(キラル中心)と呼ぶ。以下にエナンチオマーの例を示す。
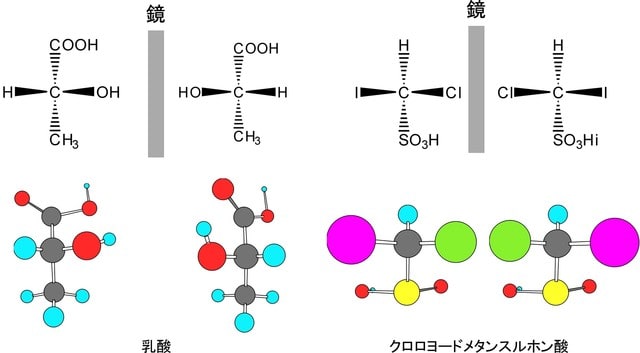
エナンチオマー以外の分子で分子式も科学結合様式も同じ立体異性体をジアステレオマーと呼ぶ。一つの分子にキラル中心が二つ以上あるとエナンチオマーの他にジアステレオマーもできる。ジアステレオマーはエナンチオマーと違って、あからさまに異なった分子として認識される。以下にその例を示す。
炭素化合物には従来から無機化合物と称される分子が存在する。その典型的なものが、一酸化炭素と二酸化炭素である。これらの分子は、以下に示す幾つかの共鳴構造によって説明されており、構造の寄与の大きさによって性質が説明されている。
一酸化炭素

二酸化炭素

















※コメント投稿者のブログIDはブログ作成者のみに通知されます