既述のページへのリンク: ①炭素という名称の起源 ②炭素の認識:木炭は何故炭素なのか ③元素としての炭素の性質 ④炭素の誕生 ⑤宇宙の炭素 ⑥原始太陽系の炭素 ⑦炭素と有機物 ⑧炭素原子とメタン分子 ⑨炭化水素分子内での炭素の結合 ➉分子内での炭素と酸素の共有結合 ⑪窒素の形成と水素と炭素と酸素 ⑫窒素を含んだ有機化合物と無機化合物 ⑬星(恒星)と炭素 ⑭炭化水素分子内での炭素―炭素結合と電子 ⑮複雑な構造の炭化水素、⑯複素環式化合物、⑰炭素化合物の多様性、⑱炭素原子と星間分子
------------------ーーーーーーーーーーー
様々な元素が星の内部や超新星爆発で作られる。どのような元素が作られるかは星の大きさ及び星を形成する材料となった元素に依存する。作られた元素は、放射性崩壊によって元素の種類をさらに増やす。これらの元素合成が行われる場所は非常に高温で、原子は単独の状態で存在する。宇宙には、極端に高温で原子の濃度が非常に高い星の内部から、極端に低温で原子の濃度が非常に低い膨張する宇宙の端まで様々な環境がある。そこには、新たな星形成領域が多数存在し、様々な濃度と温度・圧力の条件のもとに様々な元素が存在する。それらの元素が結合して形成される分子には地球では存在しないものもあると思われる。しかし、我々が知り得るのは、ある程度以上の濃度で存在し、かつ我々の持つ手段で観測可能なものに限られていて、それらは星間分子として報告されている。
宇宙における元素合成の初期には合成される元素の種類は限られており、ある程度以上の大きさを持った星の形成の場では、トリプルアルファ反応によって3個のヘリウム((4He)から炭素(12C)が形成される。この際の副次的過程として炭素(12C)がもう一つのヘリウム(4He)と融合して酸素(16O)も作られる。酸素(16O)は炭素の次に作られた安定元素である。従って、宇宙での物質形成のかなり早い段階で、炭素原子が濃厚に存在する環境に酸素原子が混在していた状況があったと考えられ、この混合物が冷却されて一酸化炭素(CO)分子が作られた可能性がある。
酸素原子(8O)には、1s軌道に2個、2s軌道に2個、2p軌道に4個の計8個の電子が存在する。このうちで分子の形成に関与する最外殻電子は、一つの2s軌道の2個の電子と三つの2p軌道の4個の電子で、計6個有ることになる。最外殻電子を8個にして安定にするには、2個の電子を何らかの方法で追加することになる。共有結合によって分子を形成することで他の原子から2個の電子を補う場合には原子価(結合手)が2という表現がされる(この表現では炭素の原子価は4となる)。ある程度温度が下がった状態で水素が濃厚に存在する環境に酸素の原子が放出されると以下の反応で水の分子が形成されると考えられる。従って宇宙の物質形成の早い時点から一酸化炭素とともに、水分子も存在したと推定される。
O + H2 → OH + H → H2O
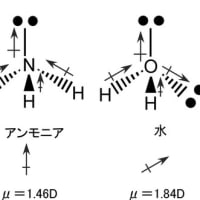
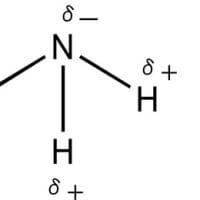
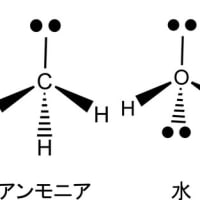
通常は酸素が共有結合によって分子を形成する場合には、sp3の混成軌道を形成する。この軌道にはメタンと同様に4方向に軌道が伸びているが、二つの軌道には、それぞれに2個ずつの電子が存在する。一つの結合軌道には最大2個の電子しか収容されないので、2個の電子が存在するこれらの軌道は他の原子の電子を共有して結合を作ることは出来ない。そのため、分子内の酸素原子には、電子で満たされた二つの軌道が共有結合に関与することなく存在する。このような電子を孤立電子対(非共有電子対)と呼ぶ。通常の構造式では孤立電子対は表示しない。ただし、孤立電子対は分子内での酸素原子における結合の角度には大きな影響を与えている(原子価殻電子対反発則、又は、電子対反発理論)。水の分子モデルを下図に示す。ただし、赤丸は酸素、「‥」は孤立電子対を意味する。

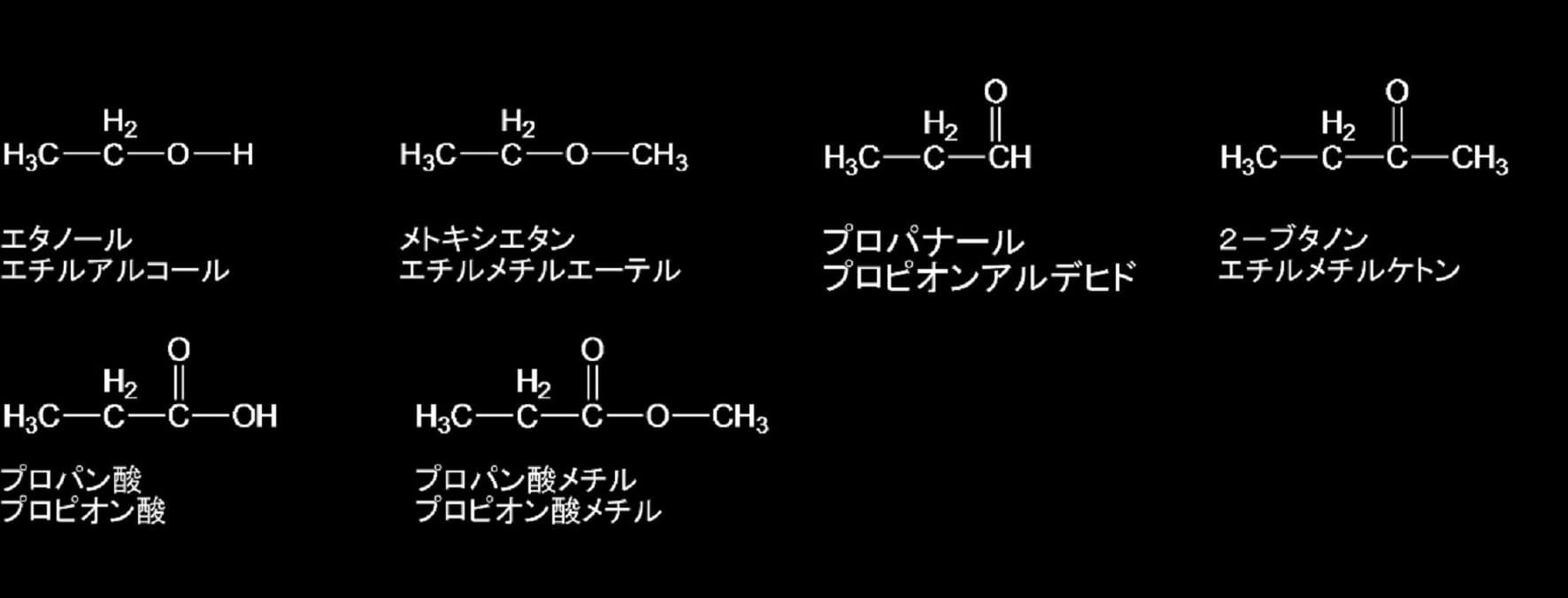
有機分子は炭化水素を基本(母体と呼ぶ)として位置付けられている。母体の炭化水素の水素原子を置換している原子又は原子団を「置換基」と総称する。置換基のうち、分子内部に導入されると母体の分子の物理的性質や化学的反応性を大きく変化させ、分子に特定の性質を付加するものを「特性基」と称する。また、有機化合物の構造をグループとして特徴づけ、同時にその性質を決めている原子および原子団を「官能基」と呼ぶ。それぞれの官能基には一般名称が与えられている。炭素と酸素と水素から形成されるものとしては、アルコール、エーテル、アルデヒド、ケトン、カルボン酸、エステルなどがそれである。それらの構造を下図に示す。ただし、RやR’の記号は通常の炭化水素又はその誘導体から1個の水素が除かれた原子団を意味する。

有機化合物で大きい分子のものには、似通った分子構造を持つものが膨大な数存在する。そのため、それらの一つ一つの化合物に無規則に名称を与えると、一つの化合物に種々の異なった名前が付けられたり、その名前がどの分子を意味するのか分からなくなったりしてしまう。そこで、分子を一定の規則に従って命名することによって、分子の名称が分かれば一対一に対応した完全な構造式が描けるようにする規則が国際純正・応用化学連合(IUPAC)によって2013年に提唱された。しかし、この提唱がなされる以前(1979年)からIUPACから有機化合物の命名に関する規則が提案され、現在でもその命名法による名称が幅広く用いられている。さらに、昔からその化合物の存在が広く知られ、固有の名称が与えられている分子も少なくないので、それらの名称の一部には慣用名として、IUPACの規則でも例外的に使用が認められているものもある。
有機分子を命名するには、置換命名法と官能種類名法の二通りの方法が従来から用いられているが、2013年の提唱では、一部の官能種類を例外として、その他の全ての化合物に置換命名法を使うこととなっている。置換命名法では、母体(置換元となった炭化水素:上図のR―H)の名称に置換基の名称を接頭語又は接尾語として結合させて呼ぶ。その結合のさせ方はIUPAC命名法によって定められている。酸素が炭素や水素と結合して作る置換基(特性基)の一般的なものとその名称を示すと、アルコールのOH(水酸基)は接頭語として「ヒドロキシ」又は接尾語として「オール」、エーテルのOR’は接頭語として「R’オキシ」、アルデヒドのCHOは接頭語として「ホルミル」又は接尾語として「カルボアルデヒド」、ケトンのCOは接頭語として「オキソ」又は接尾語として「オン」、カルボン酸のCOOHは接頭語として「カルボキシ」又は接尾語として「カルボン酸」、エステルのCOOR’は接頭語として「R’オキシカルボニル」又は接尾語として「カルボン酸R’」となる。ただし、カルボン酸の接尾語は二通りの使い方がされているので注意が必要である。一つは、COOHの炭素原子を特性基の中に含める方法で「Rカルボン酸」と命名するが、もう一つは、COOH の炭素原子を母体化合物に含まれるものとして命名する方法で、母体化合物をR-CH3としてその名称に接尾語として「酸」を付加する。アルデヒドでも類似の用法がされており、CHOのCを母体化合物に含めその母体化合物の名称に接頭語としては「オキソ」を使い、接尾語としては「アール」を使う方法である。これらの接頭語や接尾語を母体の名称に付して命名するのだが、どのような場合に接頭語にしたり接尾語したりするのかは、特性基の種類とRの構造に依存しており、IUPACの規則にはそのことも定められている。
簡単な例として、上図でRとR’が水素(H)の場合、RとR’がメチル基(CH3)の場合、およびRがエチル基(C2H5)でR’がメチル基(CH3)の場合を下に示す。Rが水素のアルコールに相当する水は、炭素が含まれていないので有機化学の範疇に無いがここでは含めて示す。構造式の下の名称は、上段が置換命名法、下段が官能種類命名法又は慣用名によるものである。
R=R’=Hの場合

R=R’=CH3の場合

R=C2H5、R’=CH3の場合
炭素と酸素が結合して形成された分子には無機化合物も存在する。基本となる分子は一酸化炭素(CO)と二酸化炭素(CO2)である。炭酸(H2CO3)は二酸化炭素(CO2)が水に溶解した状態において存在し、炭酸塩鉱物はそこから誘導される。二酸化炭素の炭素と酸素の間はそれぞれ二本の共有結合で結ばれていて、どの原子にも最外殻電子は8個ずつあり、安定な状態にある。分子モデルは下に示すようで、分子の結合方向は直線的である。

ところが、一酸化炭素(CO)の分子は一つの構造式で分子内の結合状態を表現するのが難しい。それは通常の共有結合で最外殻電子の安定条件を満たすようにするには電子が足りないからである。通常は、下図に示す三つの構造式を使って表現する。これらの構造式を共鳴構造(又は極限構造)と呼び、それぞれの共鳴構造を一定の比率で重ね合わせることで一つの電子状態を表す。これを共鳴混成体と呼ぶ。ただし、元素記号の肩に付けられた「‐」の記号は、その原子が本来持っているものより一つ多い電子が存在することを意味し、原子としては負の電荷を持つことになる。「+」の記号は一つ電子が少なく原子としては正の電荷を持つことを意味している。これらの原子はイオン化していると称し、正のイオンと負のイオンで作る結合のことをイオン結合と呼ぶ。従って一酸化炭素には共有結合とイオン結合が混合した共鳴混成体を形成していることになる。

炭素原子と酸素原子からなる星間分子として:CO、C2O、CO2、、C3O、炭素原子と酸素原子と水素原子からなる星間分子として:HCO、H2CO、H3CO、H2C2O、HCOOH、c-H2C3O、CH3OH、HC2CHO、c-C2H4O、H2CHCOH、CH3CHO、H2COHCHO、CH3OOCH、CH3COOH、CH2CHCHO、CH3OCH3、CH3CH2OH、(CH3)2CO、CH3CH2CHO、H3COC2H5、CO(CH2OH)2が報告されている。
酸素分子(O2)とHO、H2Oも報告されている。
















※コメント投稿者のブログIDはブログ作成者のみに通知されます