4ファイザー コロナワクチン安全性試験の嘘 コロナ倫理医師団
2.4. CDC, FDA and Pfizer lied about the “vaccine staying in the injection site.”
2.4. CDC、FDA、及びファイザーは、「ワクチンは注射部位に留まる」について嘘をついた。
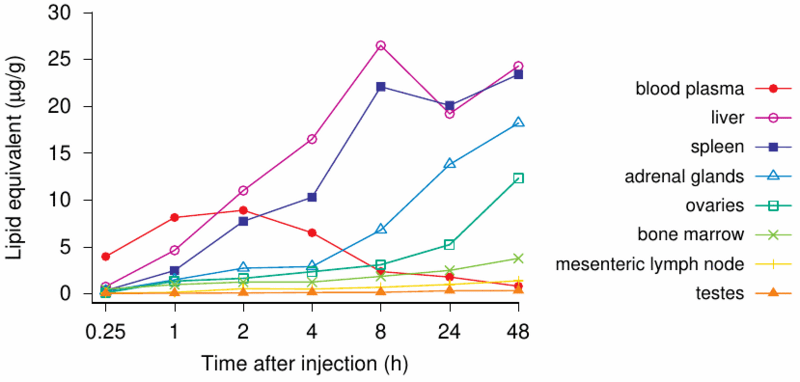
Figure 1: Distribution of a model mRNA vaccine after intramuscular injection in rats [3, p. 55f].
図1:ラットへの筋肉内注射後のモデルmRNAワクチンの分布[3、p。 55f]。
The mRNA encoded luciferase rather than the SARS-CoV-2 spike protein, but the lipid nanoparticles had the same chemical composition as Pfizer’s COVID-19 vaccine.
mRNAはSARS-CoV-2スパイクタンパク質ではなくルシフェラーゼをコードしていましたが、脂質ナノ粒子はファイザーのCOVID-19ワクチンと同じ化学組成を持っていました。
The model vaccine biodistribution study discussed in Section 2.2 clearly shows that the payload—whatever it happens to be, luciferase surrogate or a never-tested mRNA encoding for spike protein—is getting into the bloodstream and is being distributed all over the body (Figure 1).
セクション2.2で説明したモデルワクチンの生体内分布研究は、ペイロード(ルシフェラーゼサロゲートまたはスパイクタンパク質をコードするテストされていないmRNA)が血流に入り、全身に分布していることを明確に示しています(図1 )。
As is evident from the graph, there are major accumulations in adrenal glands, liver, spleen, ovaries, and other organs such as lymph nodes and bone marrow as the table below illustrates.
グラフから明らかなように、下の表が示すように、副腎、肝臓、脾臓、卵巣、およびリンパ節や骨髄などの他の器官に主要な蓄積があります。
In fact, one of the studies in rats included in the package anticipates the product reaching the bloodstream directly and includes the intravenous route of administration.
実際、パッケージに含まれているラットでの研究の1つは、製品が血流に直接到達することを予測しており、静脈内投与経路が含まれています。
This study is also based on the surrogate mRNA and not the one that encodes the spike protein.
この研究も代理mRNAに基づいており、スパイクタンパク質をコードするものではありません。
There is reason to be concerned about the clinical implications of these findings.
これらの所見の臨床的意義について懸念する理由があります。
However, since the focus of this article is the scope of Pfizer’s non-clinical program, and not an in-depth review of these studies, I refer the readers to an excellent analysis performed by scientific experts in this field [15].
ただし、この記事の焦点はファイザーの非臨床プログラムの範囲であり、これらの研究の詳細なレビューではないため、この分野の科学専門家によって実行された優れた分析を読者に紹介します[15]。
In the pre-clinical context, it must be noted that this study is incomplete: it does not fully characterize the biodistribution of the LNPs carrying their payload.
前臨床の文脈では、この研究は不完全であることに注意する必要があります。それは、ペイロードを運ぶLNPの生体内分布を完全に特徴づけるものではありません。
The study was stopped while the concentrations in multiple organs were still increasing, and therefore it is not possible to say what the true maximum concentrations in these organs would have been.
複数の臓器の濃度がまだ上昇している間に研究を中止したため、これらの臓器の真の最大濃度が何であったかを言うことはできません。
No follow-on studies elucidating the complete time course of distribution, time to maximum concentration, maximum concentrations observed, and time to clearance were performed or planned.
分布の完全な時間経過、最大濃度までの時間、観察された最大濃度、およびクリアランスまでの時間を解明する後続の研究は実施または計画されていません。
No estimates of the therapeutic safety margins were provided.
治療上の安全マージンの推定値は提供されていません。
(訳注:
各臓器の濃度がまだ増加途中の48時間までのデータしか出されておらず、また、心臓や脳のデータもありません。実験を途中で打ち切り、何らかの不都合なデータを故意に隠しているようにも見えます。
いずれにせよ、LNPの中身が代替物では話しにならず、本物のスパイクタンパクのmRNAをLNPに入れて評価しなければ本当のことは分かりません。現時点での知識では、スパイクタンパクのmRNAをLNPに入れたものは、血管内皮細胞を破壊するため、全身の臓器へのmRNAの漏出が発生し、各種臓器内の濃度は大きく異なると考えられます。
追加実験による検証が必要です。)
Overall, the non-clinical testing program appears woefully incomplete.
全体として、非臨床試験プログラムはひどく不完全に見えます。
This fact was clearly noted in the European Medicines Agency (EMA) summary document of the “Comirnaty” BNT162b2 vaccine.
この事実は、「Comirnaty」BNT162b2ワクチンのEuropean Medicines Agency(EMA)要約文書に明確に記載されています。
The reviewers share an explicit admission [16, p. 45] that
レビューアは明示的な告白を共有します[16、p。 45]
no traditional pharmacokinetic or biodistribution studies have been performed with the vaccine candidate BNT162b2.
ワクチン候補BNT162b2を用いた従来の薬物動態学的または生体内分布研究は実施されていません。
Additionally, on page 54, they state that
さらに、54ページで、彼らは次のように述べています
several literature reports indicate that LNP-formulated RNAs can distribute rather nonspecifically to several organs such as spleen, heart, kidney, lung, and brain. In line with this, results from the newly transmitted study 185350, indicate a broader biodistribution pattern.
いくつかの文献報告は、LNPで処方されたRNAが、脾臓、心臓、腎臓、肺、脳などのいくつかの器官にかなり非特異的に分布する可能性があることを示しています。 これと一致して、新たに送信された研究185350の結果は、より広い生体内分布パターンを示しています。
Although the biodistribution study was not performed according to industry GLP standards, its results strongly suggest that lipid nanoparticles with mRNA which codes for the spike protein will reach the bloodstream, circulate throughout the body, and then accumulate in a variety of organs and tissues.
生体内分布研究は業界のGLP基準に従って実施されていませんが、その結果は、スパイクタンパク質をコードするmRNAを含む脂質ナノ粒子が血流に到達し、体全体を循環し、さまざまな臓器や組織に蓄積することを強く示唆しています。
If this results in spike protein expressed in those organs, it will both stimulate immunity and cause those same cells to be attacked by the immune system.
これがそれらの器官で発現されるスパイクタンパク質をもたらす場合、それは免疫を刺激し、それらの同じ細胞を免疫系によって攻撃させるでしょう。
The resulting “vaccine reactogenicity” could resemble clinical symptoms seen with autoimmune syndromes of variable severity, in some cases severe enough to cause death or permanent disability; this conclusion is indeed strongly supported by the aforementioned autopsy study [14].
結果として生じる「ワクチン反応原性」は、さまざまな重症度の自己免疫症候群で見られる臨床症状に似ている可能性があり、場合によっては、死亡または永続的な障害を引き起こすのに十分な重症度です。 この結論は、前述の剖検研究[14]によって確かに強く支持されています。
With the roll-out of the vaccines globally, these exact types of adverse events have been reported in thousands in the vaccine adverse event reporting systems, yet no public health agency has yet made a connection between this pre-clinically documented mechanism and the alarming current health outcomes data.
ワクチンが世界的に展開されるにつれ、これらの正確なタイプの有害事象は、ワクチン有害事象報告システムで数千件報告されています。しかし、この前臨床的に文書化されたメカニズムと現在の驚くべき健康転帰データとの間に、関係を築いている公的医療機関はまだありません。
2.5. Pfizer skipped major categories of safety testing altogether
2.5。 Pfizerは、安全性テストの主要なカテゴリを完全にスキップしました
Even more elucidating is what Pfizer chose NOT to study, i.e., the entire pharmacology sections related to safety and risk characterization.
さらに解明されているのは、ファイザーが研究しないことを選択したことです。つまり、安全性とリスクの特性評価に関連する薬理学のセクション全体です。
Specifically, the non-clinical document package states [3]:
具体的には、非臨床文書パッケージには次のように記載されています[3]。
2.4.2.2. Secondary Pharmacodynamics
2.4.2.2。 二次薬物動態
No secondary pharmacodynamics studies were conducted with BNT162b2.
BNT162b2では二次的な薬物動態研究は実施されていません。
2.4.2.3. Safety Pharmacology
2.4.2.3。 安全薬理学
No safety pharmacology studies were conducted with BNT162b2 as they are not considered necessary for the development of vaccines according to the WHO guideline (WHO, 2005).
BNT162b2は、WHOガイドライン(WHO、2005)に従ってワクチンの開発に必要であるとは考えられていないため、安全薬理学研究は実施されませんでした。
2.4.2.4. Pharmacodynamic Drug Interactions
2.4.2.4。 薬力学的薬物相互作用
Nonclinical studies evaluating pharmacodynamic drug interactions with BNT162b2 were not conducted as they are generally not considered necessary to support development and licensure of vaccine products for infectious diseases (WHO, 2005).
BNT162b2との薬物力学的薬物相互作用を評価する非臨床研究は、感染症用のワクチン製品の開発と認可を支援するために一般に必要であるとは考えられていないため、実施されませんでした(WHO、2005)。
…..
2.4.4.4. Genotoxicity 2.4.4.4。 遺伝毒性
No genotoxicity studies are planned for BNT162b2 as the components of the vaccine construct are lipids and RNA and are not expected to have genotoxic potential (WHO, 2005).
ワクチン構築物の成分は脂質とRNAであり、遺伝毒性の可能性があるとは予想されないため、BNT162b2の遺伝毒性研究は計画されていません(WHO、2005)。
(訳注: 人工的に化学合成された化学物質である脂質の遺伝毒性は予想されるため、評価するのが当たり前です。また、RNAに関しては、人類が進化の途上で非常に多くのRNAを遺伝子に取り込んできた歴史がありますから、遺伝毒性の評価が必要です。)
2.4.4.5. Carcinogenicity 発がん性
Carcinogenicity studies with BNT162b2 have not been conducted as the components of the vaccine construct are lipids and RNA and are not expected to have carcinogenic or tumorigenic potential. Carcinogenicity testing is generally not considered necessary to support the development and licensure of vaccine products for infectious diseases (WHO, 2005).
ワクチン構築物の成分は脂質とRNAであり、発癌性または腫瘍形成性の可能性があるとは予想されないため、BNT162b2を使用した発癌性研究は実施されていません。 発癌性試験は、一般に、感染症用のワクチン製品の開発と認可を支援するために必要であるとは考えられていません(WHO、2005)。
(訳注: 人工的に化学合成された化学物質である脂質の発癌性は予想されるため、評価するのが当たり前です。また、RNAに関しては、DNA→RNA→タンパク質という人体の遺伝暗号システムのソフトウェア―をハッキングして乗っ取り、強制的に人工的なタンパクを作らせるのですから、発癌性の危険性は否定できませんので試験が必要です。)
Let’s review what safety studies Pfizer decided to omit entirely.
Pfizerが完全に省略した安全性試験を確認しましょう。
2.5.1. What is Safety Pharmacology?
2.5.1. 安全薬理学とは何ですか?
The aim of safety pharmacology is to characterize the pharmacokinetic/pharmacodynamic (PK/PD) aspects of a drug’s adverse effects.
安全薬理学の目的は、薬物の副作用の薬物動態/薬力学(PK / PD)の側面を特徴づけることです。
Pharmacodynamics aims to describe how the drug acts on the body, while pharmacokinetics examines where in the body does the drug go, how long does it stay there, and how is it eliminated.
薬力学は、薬物が体にどのように作用するかを説明することを目的としていますが、薬物動態学は、薬物が体内のどこに行き、どのくらいの期間そこに留まり、どのように排除されるかを調べます。
A safety pharmacology ‘core battery’ comprises studies to determine the potential undesirable effects of a drug on the central nervous, cardiovascular, and respiratory systems.
安全薬理学の「コアバッテリー」は、中枢神経系、心臓血管系、および呼吸器系に対する薬物の潜在的な望ましくない影響を決定するための研究で構成されています。
It also includes supplementary tests to evaluate other organ systems (liver, kidney, blood, etc.) if there are potential risks of damage to these systems.
また、他の臓器システム(肝臓、腎臓、血液など)に損傷を与える可能性がある場合に、これらのシステムを評価するための補足テストも含まれています。
2.5.2. What are Secondary Pharmacodynamics Studies?
2.5.2。 二次薬力学研究とは何ですか?
Assessments of new drugs for pharmacological activities on targets other than the therapeutically desired one are called Secondary Pharmacodynamics.
治療上望ましいもの以外の標的に対する薬理学的活性についての新薬の評価は、二次薬物動態と呼ばれる。
For an entirely novel class of biological compound with completely novel and undisclosed excipients,1 it is completely unacceptable to omit the evaluation of secondary pharmacodynamics of the whole product or of its novel components.
完全に新規で非公開の賦形剤を含む完全に新規のクラスの生物学的化合物1については、製品全体またはその新規成分の二次薬力学の評価を省略することは完全に容認できません。
2.5.3. What are Drug Interaction Studies?
2.5.3。 薬物相互作用研究とは何ですか?
Drug interactions studies are designed to assess potential harmful effects from interactions of the novel pharmaceutical product with existing medicines which a patient may be taking.
薬物相互作用研究は、患者が服用している可能性のある既存の医薬品との新規医薬品の相互作用による潜在的な有害作用を評価するように設計されています。
For example, such simultaneous drug application will place additional burdens on major drug-metabolizing organs, particularly the liver.
例えば、そのような同時の薬物適用は、主要な薬物代謝器官、特に肝臓に追加の負担をかけるでしょう。
2.5.4. What are Genotoxicity and Carcinogenicity Studies?
2.5.4。 遺伝毒性および発癌性研究とは何ですか?
These studies are designed to evaluate the risk of possible damage to the DNA and related cellular processes, and to evaluate the risk of promoting cellular damage and cancer formation.
これらの研究は、DNAおよび関連する細胞プロセスへの損傷の可能性のリスクを評価し、細胞損傷および癌形成を促進するリスクを評価するように設計されています。
DNA/RNA-based novel technologies have obvious genotoxic potential.
DNA / RNAベースの新しい技術には、明らかな遺伝毒性の可能性があります。
One straightforward mechanism of genetic damage is the incorporation of the injected nucleic acid into the host cell genome.
遺伝的損傷の簡単なメカニズムの1つは、注入された核酸が宿主細胞のゲノムに組み込まれることです。
This is well known with viral vectors such as the adenovirus-derived ones used by the Johnson & Johnson and AstraZeneca vaccines [17], but it has recently also been demonstrated with the Pfizer mRNA vaccine in a human liver cell line [18].
これは、ジョンソン&ジョンソンワクチンやアストラゼネカワクチンで使用されるアデノウイルス由来のものなどのウイルスベクターでよく知られていますが[17]、最近ではヒト肝細胞株のファイザーmRNAワクチンでも実証されています[18]。
The mechanism is likely the same as that previously demonstrated in case of the genomic insertion of sequences derived from the SARS-CoV-2 virus, that is, reverse transcription of the mRNA into a DNA copy by cellular retrotransposon, followed by chromosomal insertion of that DNA copy [19].
メカニズムは、SARS-CoV-2ウイルスに由来する配列のゲノム挿入の場合、つまり、細胞レトロトランスポゾンによるDNAコピーへのmRNAの逆転写と、それに続くそのDNAコピーの染色体挿入の場合に以前に示されたものとおそらく同じです。 [19]。
A second potential pathway to genotoxicity is the metabolic activity of the cationic lipids, which disrupt mitochondrial respiration and thereby cause the production of reactive oxygen species, which may chemically damage DNA [20–22].
遺伝毒性への2番目の潜在的な経路は、カチオン性脂質の代謝活性であり、ミトコンドリアの呼吸を妨害し、それによって反応性酸素種の生成を引き起こし、DNAを化学的に損傷する可能性があります[20–22]。
Pfizer’s mRNA vaccine was never tested to exclude these risks—neither in animals nor in humans.
PfizerのmRNAワクチンは、動物でも人間でも、これらのリスクを排除するためにテストされたことはありません。
The next logical question is: what rationale was used to waive this entire category of pharmacological safety testing?
次の論理的な質問は、このカテゴリーの薬理学的安全性試験全体を放棄するためにどのような理論的根拠が使用されたかということです。
It bears mention that Moderna conducted some preliminary genotoxicity studies on their own mRNA vaccine, which is very similar to Pfizer’s.
Modernaが、Pfizerと非常によく似た独自のmRNAワクチンについていくつかの予備的な遺伝毒性研究を実施したことは言及に値します。
These studies employed the erythrocyte micronucleus assay.
これらの研究では、赤血球微小核アッセイを採用しました。
A so-called micronucleus is a chromosome fragment which was produced by chromosome damage [23,24] and then left behind in the cytoplasm when the main nucleus was expelled.
いわゆる微小核は、染色体損傷によって生成され[23,24]、主核が排出されたときに細胞質に残された染色体断片です。
The test, which counts the number of red blood cells with such micronuclei, is widely used to assess genotoxicity in vivo [24].
このような微小核を持つ赤血球の数を数えるこの検査は、invivoでの遺伝毒性を評価するために広く使用されています[24]。
The EMA assessment report summarizes and comments as follows [25]:
EMA評価レポートは、次のように要約およびコメントしています[25]。
Another GLP-compliant in vivo micronucleus study in rat was performed with mRNA-1706 in SM-102-containing lipid nanoparticles using IV administration.
ラットにおける別のGLP準拠のinvivo微小核研究は、IV投与を使用してSM-102含有脂質ナノ粒子中のmRNA-1706で実施されました。
In this study statistically significant increases in micronucleated erythrocytes were reported in both sexes. …
この研究では、小核赤血球の統計的に有意な増加が雄雌ともに報告されました。 …
In the toxicological studies conducted in rat, various non-genotoxic effects that could impact on the increase of micronucleated erythrocytes in this species were observed: hyperthermia, disturbance of erythropoiesis … and inflammation of the spleen, which could affect clearance of micronucleated cells from the blood.
ラットで実施された毒物学的研究では、この種の小核赤血球の増加に影響を与える可能性のあるさまざまな非遺伝毒性効果が観察されました:高体温、赤血球生成の障害…および血液からの小核細胞のクリアランスに影響を与える可能性のある脾臓の炎症 。
In other words, the positive genotoxicity signal was speculatively blamed on other possible causes, without actually carrying out any experimental follow-on studies to decide this crucial question.
言い換えれば、陽性の遺伝毒性シグナルは、この重要な問題を決定するための実験的な後続研究を実際に実施することなく、他の考えられる原因について推測的に非難されました。
Invoking the vaccine-induced inflammation of the spleen to explain away vaccine-induced genotoxicity certainly takes the cake.
ワクチンによって誘発された遺伝毒性を説明するために、ワクチンによって誘発された脾臓の炎症を使うことは、確かに一番素晴らしい。
2.6. Pfizer used dishonest and self-serving interpretation of regulatory guidelines to avoid routine safety testing
2.6. Pfizerは、普通の安全性テストを回避するために、規制ガイドラインの不正で自己利益的な解釈を使用しました
Numerous mechanisms of injury to major organ systems had been documented for the spike protein of SARS-CoV-2 before the vaccine roll-out [11,26–28], and previous efforts to develop vaccines against the original SARS virus had failed due to antibody-dependent enhancement, which caused vaccinated animals to fare worse than the unvaccinated controls upon viral challenge [29,30].
ワクチンの展開前に、SARS-CoV-2のスパイクタンパク質について、主要な臓器系への損傷の多くのメカニズムが報告されていました[11,26–28]。
元のSARSウイルスに対するワクチンを開発するための以前の取り組みは、ワクチン接種された動物は、ウイルス暴露の際にワクチン接種されていない対照よりも悪くなる抗体依存性増強のために失敗しました[29,30]。
Thus, there was abundant reason for concern regarding the safety of Pfizer’s mRNA-based vaccine, which also would deploy the spike protein as the antigen.
したがって、スパイクタンパク質を抗原として展開するファイザーのmRNAベースのワクチンの安全性に関して懸念する理由はたくさんありました。
Yet, Pfizer claimed to the FDA that safety pharmacology, secondary pharmacodynamic, genotoxicity or carcinogenicity studies were not necessary for their product, and as justification of this claim, Pfizer cited the World Health Organization’s Guidelines for Vaccine Development from 2005.
それでも、ファイザーはFDAに対して、安全薬理学、二次薬力学、遺伝毒性または発癌性の研究は製品に必要ではないと主張し、この主張の正当化として、ファイザーは2005年からのワクチン開発に関する世界保健機関のガイドラインを引用しました。
Pfizer’s product was only arbitrarily reclassified as a vaccine in 2020.
ファイザーの製品は、2020年にワクチンとして恣意的に再分類されただけです。
Prior to that, it would have been categorized as a gene therapy; thus, back in 2005 when the WHO guidelines were written, it would not have been regarded as a vaccine.
それ以前は、遺伝子療法として分類されていました。 したがって、WHOガイドラインが作成された2005年には、ワクチンとは見なされていなかったでしょう。
(訳注: ファイザーの製品は、遺伝子治療であり、2005年のWHOガイドラインのワクチンには当てはまらない。よって、このWHOガイドラインを使用して安全性試験を実施し申請することはできない。ファイザーの主張は嘘。)
Furthermore, the 2005 recommendations from WHO did not anticipate the use of gene therapy platforms for vaccines.
さらに、WHOからの2005年の勧告は、ワクチンのための遺伝子治療プラットフォームの使用を予期していませんでした。
Additionally, it is the responsibility of the FDA and other regulatory bodies worldwide to regulate the authorization and licensing of medical products.
さらに、医療製品の承認と許可の規制は、FDAおよび世界中の他の規制機関の責任です。
WHO does not have this authority, as it is only an advisory and coordination non-governmental body.
WHOはこの権限を持っていません。これは、諮問および調整のための非政府機関にすぎないのです。
2.6.1. What Do the WHO Recommendations from 2005 Really State?
2.6.1. 2005年のWHO勧告は本当は何を述べていますか?
The WHO Guidelines on the non-clinical evaluation of vaccines [31] state that pharmacokinetics studies are not normally needed but should be considered on a case-by-case basis (§4.2.6), and toxicity studies should be performed whenever new excipients (and preservatives) are used, for which no toxicological data exist (§5.2).
ワクチンの非臨床評価に関するWHOガイドライン[31]は、薬物動態研究は通常は必要ではないが、ケースバイケースで検討されるべきであると述べています(§4.2.6)。毒物学的データが存在しない新しい賦形剤(および防腐剤)を使用する場合は常に、毒性研究を実施する必要があります(§5.2)。
Safety pharmacology is covered in §4.2.4, which states:
安全薬理学は§4.2.4でカバーされており、次のように述べています。
The purpose of safety pharmacology is to investigate the effects of the candidate vaccine on vital functions.
安全薬理学の目的は、重要な機能に対する候補ワクチンの効果を調査することです。
If data from nonclinical and/or human clinical studies suggest that the vaccine … may affect physiological functions (e.g. central nervous system, respiratory, cardiovascular and renal functions) other than those of the immune system, safety pharmacology studies should be incorporated into the toxicity assessment.
非臨床および/またはヒトの臨床研究からのデータが、ワクチンが…免疫系以外の生理学的機能(例えば、中枢神経系、呼吸器、心臓血管および腎機能)に影響を与える可能性があることを示唆する場合、安全薬理学研究を毒性評価に組み込む必要があります 。
Useful information on this topic can be found in the Note for Guidance on safety pharmacology studies for human pharmaceuticals.
このトピックに関する有用な情報は、ヒト用医薬品の安全薬理学研究に関するガイダンスの注記に記載されています。
Thus, it is clear that the WHO guidelines do indicate a need for safety pharmacology studies in cases such as the SARS-CoV-2 spike protein, with its many documented untoward effects.
したがって、WHOガイドラインが、SARS-CoV-2スパイクタンパク質などの場合の安全薬理学研究の必要性を示しており、その多くの有害な影響が文書化されていることは明らかです。






















