というわけで、論文が出たので想い出話をするコーナー(?)の三回目です。
(一回目→こちら 二回目→こちら)
今回はこの研究のキモでもあるキラルリン酸の話をば。
ボクのやっていた不斉臭素化反応では、(R)-BINOLから合成できる、3,3'位に9-アントリル基を持つ還元型のリン酸を使っています。
3,3'位に9-アントリル基を持つリン酸というのは結構いろいろな論文で見られますね。
このBINOL由来のリン酸の3,3'位につける置換基はざっくり分けると「電子求引性基をもつもの」と「嵩高い置換基」の2種類がよく使われます。
前者だとトリフルオロメチルだとかニトロ基なんかを持つ芳香族化合物が多いです。
後者だとナフチルやアントリルなど「平面的」に嵩高いもの、2,4,6-トリイソプロピルフェニルのように「立体的」に嵩高いもの、あるいはトリフェニルシリルのようにケイ素を含む置換基などと区分できます(世界的に一般的かどうかは知らないが)。
さて、このリン酸合成も原料合成と同じくめんどくさかったです(ぉ
これがざっくりとした合成経路。
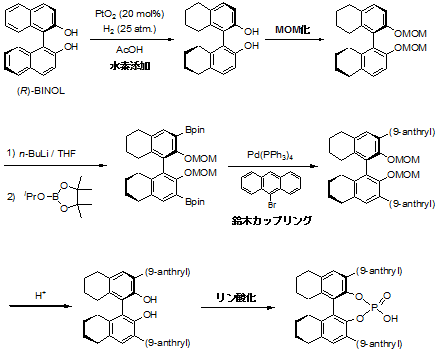
まずボクの使っていたキラルリン酸の場合、まず最初に芳香環の還元をしないといけないわけです。
どんな方法でやるか?
芳香環の還元と言えば教科書的にはバーチ還元か!? と思わなくもないですが、さすがにあんなえぐいのはやりません( =ω=)
答えは水素添加。
オートクレーブを使い、酢酸溶媒中、酸化白金を触媒としてガンガン圧力をかけて水素添加しちゃいます。
これもかなり強引な方法ですが、芳香環をぶっ壊すぐらいだからこれくらいは必要なのでした。
こうすると、BINOLの後ろ側(OH基の付いてない側)の芳香環だけが綺麗に還元されます。
この反応をやるときは「酸化白金使ってるし、失敗したら高くつくよー?(・∀・)」と先輩とかによくプレッシャーをかけられたものです。
何気に酸化白金も20mol%使うしね…
その後、ヒドロキシ基をMOM化→オルトリチオ化→ボレート化→鈴木カップリングの流れで3,3'位に置換基を導入し、MOM除去→リン酸化の流れで触媒を合成するのです。
還元型の場合、オルトリチオ化→ボレート化がなかなか大変でしたね。
本当ならエーテルを使いたいけど、MOM化BINOLが溶けないのでTHFを溶媒にして、n-BuLiを入れるわけですが、通常のBINOLのオルトリチオ化と違い、ベンジルプロトンがあるせいかどうなのか、ボレート化すると収率がよくない。
さらに、使うボレートはトリイソプロピルボレートとピナコールを混ぜて作ったピナコールボレートだけど、こいつがやたら安定性悪くて使いにくいのでした。
精製も減圧蒸留だしな…
リン酸合成の際、あまりにもこの反応が嫌いだった(特にBpinの合成のところ)ので、オルトリチオ化の後、直接、トリイソプロピルボレートを加え、その後に酸クエンチすれば、MOMも外れるかもしれんけどホウ酸化できるんじゃないかと思い、M2の終わり頃にあれこれやった覚えがあります。
結果は…なんかよくわからんかった。
とにかくNMRが汚いし、現物見ても汚いしで出来てる気配がなかったような。
とりあえず精製せずに鈴木カップリングをやったけど、この結果もなかなかに汚くて…
なんとかしてもっといい合成方法を確立したかったですね。
ボクのいた研究室では、新しく入ってきたB4にはまず最初に演習実験としてリン酸触媒の合成をしてもらうから、合成過程に減圧蒸留とかあるのはいいんだけど、M1やM2がなるたけ早く触媒合成したときなんかはあまりやりたいくないですからねぇ…それも精製したモノが不安定だったりするとなおさら。
最初に3~4gのBINOLを使って、最終的に1~2gでも触媒ができればだいぶ健闘した感じになるか。
という感じで、ビアリールの原料と触媒が両方とも底を尽きそうになったときは、同時進行で合成した
りしてなかなか大変ですた(´=ω=)
ときに、何故BINOLを還元してるか? だけど、これはBINOLの上の芳香環と下の芳香環の二面角を広げるためです。
単純なBINOLだと8,8'位がsp2炭素だけど、還元型だとsp3炭素になり、立体的に水素がぶつかることでより捻じれるという具合。
それがそんなに不斉に影響を与えるのかと思うかもしれないけど、やはり触媒反応点の最適なポケットの
大きさというものはあるようで、同条件で10% ee以上は結果に差が出て、なかなか侮れません。
いやぁ、使うのうはいいけど、もう作りたくないですね(ぉ
(一回目→こちら 二回目→こちら)
今回はこの研究のキモでもあるキラルリン酸の話をば。
ボクのやっていた不斉臭素化反応では、(R)-BINOLから合成できる、3,3'位に9-アントリル基を持つ還元型のリン酸を使っています。
3,3'位に9-アントリル基を持つリン酸というのは結構いろいろな論文で見られますね。
このBINOL由来のリン酸の3,3'位につける置換基はざっくり分けると「電子求引性基をもつもの」と「嵩高い置換基」の2種類がよく使われます。
前者だとトリフルオロメチルだとかニトロ基なんかを持つ芳香族化合物が多いです。
後者だとナフチルやアントリルなど「平面的」に嵩高いもの、2,4,6-トリイソプロピルフェニルのように「立体的」に嵩高いもの、あるいはトリフェニルシリルのようにケイ素を含む置換基などと区分できます(世界的に一般的かどうかは知らないが)。
さて、このリン酸合成も原料合成と同じくめんどくさかったです(ぉ
これがざっくりとした合成経路。

まずボクの使っていたキラルリン酸の場合、まず最初に芳香環の還元をしないといけないわけです。
どんな方法でやるか?
芳香環の還元と言えば教科書的にはバーチ還元か!? と思わなくもないですが、さすがにあんなえぐいのはやりません( =ω=)
答えは水素添加。
オートクレーブを使い、酢酸溶媒中、酸化白金を触媒としてガンガン圧力をかけて水素添加しちゃいます。
これもかなり強引な方法ですが、芳香環をぶっ壊すぐらいだからこれくらいは必要なのでした。
こうすると、BINOLの後ろ側(OH基の付いてない側)の芳香環だけが綺麗に還元されます。
この反応をやるときは「酸化白金使ってるし、失敗したら高くつくよー?(・∀・)」と先輩とかによくプレッシャーをかけられたものです。
何気に酸化白金も20mol%使うしね…
その後、ヒドロキシ基をMOM化→オルトリチオ化→ボレート化→鈴木カップリングの流れで3,3'位に置換基を導入し、MOM除去→リン酸化の流れで触媒を合成するのです。
還元型の場合、オルトリチオ化→ボレート化がなかなか大変でしたね。
本当ならエーテルを使いたいけど、MOM化BINOLが溶けないのでTHFを溶媒にして、n-BuLiを入れるわけですが、通常のBINOLのオルトリチオ化と違い、ベンジルプロトンがあるせいかどうなのか、ボレート化すると収率がよくない。
さらに、使うボレートはトリイソプロピルボレートとピナコールを混ぜて作ったピナコールボレートだけど、こいつがやたら安定性悪くて使いにくいのでした。
精製も減圧蒸留だしな…
リン酸合成の際、あまりにもこの反応が嫌いだった(特にBpinの合成のところ)ので、オルトリチオ化の後、直接、トリイソプロピルボレートを加え、その後に酸クエンチすれば、MOMも外れるかもしれんけどホウ酸化できるんじゃないかと思い、M2の終わり頃にあれこれやった覚えがあります。
結果は…なんかよくわからんかった。
とにかくNMRが汚いし、現物見ても汚いしで出来てる気配がなかったような。
とりあえず精製せずに鈴木カップリングをやったけど、この結果もなかなかに汚くて…
なんとかしてもっといい合成方法を確立したかったですね。
ボクのいた研究室では、新しく入ってきたB4にはまず最初に演習実験としてリン酸触媒の合成をしてもらうから、合成過程に減圧蒸留とかあるのはいいんだけど、M1やM2がなるたけ早く触媒合成したときなんかはあまりやりたいくないですからねぇ…それも精製したモノが不安定だったりするとなおさら。
最初に3~4gのBINOLを使って、最終的に1~2gでも触媒ができればだいぶ健闘した感じになるか。
という感じで、ビアリールの原料と触媒が両方とも底を尽きそうになったときは、同時進行で合成した
りしてなかなか大変ですた(´=ω=)
ときに、何故BINOLを還元してるか? だけど、これはBINOLの上の芳香環と下の芳香環の二面角を広げるためです。
単純なBINOLだと8,8'位がsp2炭素だけど、還元型だとsp3炭素になり、立体的に水素がぶつかることでより捻じれるという具合。
それがそんなに不斉に影響を与えるのかと思うかもしれないけど、やはり触媒反応点の最適なポケットの
大きさというものはあるようで、同条件で10% ee以上は結果に差が出て、なかなか侮れません。
いやぁ、使うのうはいいけど、もう作りたくないですね(ぉ















※コメント投稿者のブログIDはブログ作成者のみに通知されます