

新薬開発で日本回避懸念 製薬各社、薬価改定に反発
3/17(土) 17:02
時事通信
新薬開発で日本回避懸念 製薬各社、薬価改定に反発
日本製薬工業協会の畑中好彦会長
高齢化進展による増加基調の社会保障費を抑制するため、厚生労働省が昨年末に決定した医薬品の公定価格(薬価)の抜本改革に対し、製薬各社の反発が収まらない。日本製薬工業協会の畑中好彦会長(アステラス製薬社長)は「国民皆保険維持は、社会保障全体で議論すべきで、薬価だけで財政の調整をするのは限界に来ている」と指摘し、「革新的新薬の研究開発や安定供給を著しく阻害する」と批判した。
しわ寄せは製薬業界に
社会保障費抑制では、医療費全体の抜本的な見直しが期待されていたが、医師の診察料は引き上げられる一方で、しわ寄せを被ったのは薬剤費。革新的新薬などの薬価引き下げを一定期間猶予する「新薬創出加算制度」が大幅に縮小され、日本での新薬開発を後回しにする「ドラッグ・ラグ」問題の再燃が懸念されている。製薬各社が新薬開発で従来のように欧米を優先し、日本を後回しにすれば、最新の抗がん剤などが国内で使える時期が遅れる恐れがある。
新薬開発は10年程度の期間と1000億円以上の費用がかかるが、既存薬と効き目に大幅な差異が出なかったり、重篤な副作用が見つかったりすると、開発中止もあるリスクが高いビジネス。化学合成による従来の医薬品とは異なり、遺伝子工学を応用し、微生物や動物細胞など生物由来の物質から作るバイオ医薬品も登場し、開発費はさらに膨らんでいるのが現状だ。
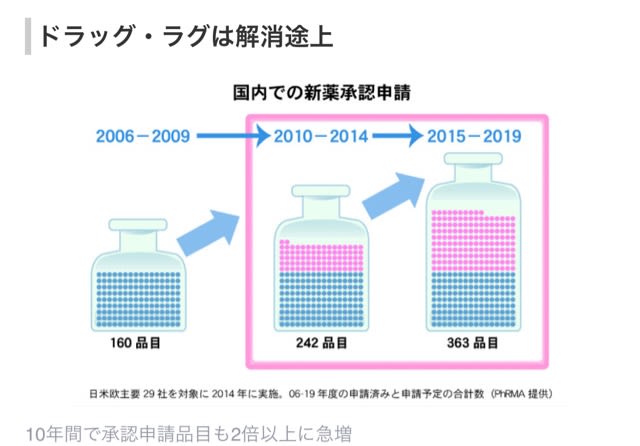
ドラッグ・ラグは解消途上
新薬開発で日本回避懸念 製薬各社、薬価改定に反発
10年間で承認申請品目も2倍以上に急増
日本国内では2000年代まで、開発が遅れたり着手しなかったりして、欧米で治療に使われている医薬品が利用できない「ドラッグ・ラグ」が問題になっていた。新薬の審査期間が長かったほか、海外よりも2~6倍かかる開発時の臨床試験費用の高さがネックとなり、製薬各社が日本での開発を後回しにしていたことが原因だ。
厚生労働省は事態打開に向け、迅速に新薬の審査ができる体制を整え、10年度には新薬創出加算制度を導入。こうした努力により欧米での共同臨床試験に日本も組み込まれ、日米欧の同時開発が進むなどして、ドラッグ・ラグは解消に向かっていた。米国研究製薬工業協会(PhRMA)の試算では、06~09年に平均42カ月だった日本のドラッグ・ラグは10~14年に15カ月に縮まり、15~19年にはさらに5カ月まで短縮するという。
厚労省は「ドラッグ・ラグは解消してきている」などとして、新薬創出加算の縮小を決めたが、解消を促した加算制度の魅力がなくなれば、海外メーカーを中心に日本への投資マインドを冷え込ませることになる。国内製薬大手幹部は「すぐに影響は出ないが、欧米で発売された新薬が日本で出ない事態を数年後に再び目の当たりにするかもしれない」と警告。業界関係者からは「日本で新薬開発が遅れると、数千万円かけて海外で治療が受けられる高所得者のみの命が助かる」との声も上がっている。
オプジーボ値下げも影響か小野薬品工業の抗がん剤「オプジーボ」の緊急値下げもドラッグ・ラグ拡大に影響しそうだ。製薬業界は開発中止リスクがあるビジネスのため、市場環境の急な価格の変化で収益見通しが修正されるのを好まない。「急に大幅値下げされては将来の投資計画が立てられず、日本での開発をためらうかもしれない」(外資系製薬大手)と話す。
皮膚がん治療薬のオプジーボが肺がんでも使用できるようになり、患者数が30倍以上に急増。患者1人当たり年間3500万円かかる高額医薬品だったこともあり、医療財政を圧迫するとして問題視された。通常2年ごとの薬価見直しルールがほごにされ、1年以上前倒しして薬価が半額に引き下げられることになった経緯がある。18年度からはさらに引き下げられ、発売時よりも6割超安くなる。
そもそも特許期間中に薬価が下がるのは日本だけといい、「オプジーボのように使用できる病気を増やす努力をすると、特許期間中でも薬価が下げられることも問題だ」(海外製薬大手幹部)とし、投資先としての日本市場への不信感は高まっていた。
PhRMAのパトリック・ジョンソン在日執行委員会委員長(日本イーライリリー社長)は「新薬創出加算の導入後は、新薬の申請品目数が42%増加するなど、日本での開発は活発化していた」と述べ、改定はメーカーの開発意欲をそぐと残念がる。新薬加算の対象は約920品目から約540品目に絞られ、約4割減少するという。
第2の「リピトール」生まれないは時事通信とのインタビューに応じ、昨年末の薬価改定で新薬加算制度の対象を、同じ病気の薬剤で最初のものが発売されてから3年以内の3製品までに制限したことに懸念を表明した。
同社はかつて、ピーク時の年間売上高が129億ドル(約1兆4000億円)と、大ヒットとされる10億ドル(約1080億円)を大幅に超える高脂血症治療薬「リピトール」を発売している。しかし、梅田氏は「リピトールはこの領域の1番手が出てから随分遅れて発売しており、3年以内に3製品という限定がある現在であれば、開発を続けて大丈夫かという議論になっただろう」と述べた。今後は第2のリピトールのように、薬効が高く世界的にヒットする製品でも、開発時期や他製品の発売状況を理由に、日本では開発されないケースが出てくることを示唆した。
また梅田氏は「必ずしも最初に出た製品だけが素晴らしいのではなく、後に出てくる製品の方が優れた改善がなされていることは当然あり得る」と話した。花粉症薬を例に挙げ、「当初出た薬は眠くなったり便秘を起こしたりしていたが、少しずつ改善している」と機械的に「3年以内3製品」と設定したことに批判的だ。国内大手の経営トップも「患者の負担が小さくなる改良型の新薬の開発が今後は滞るだろう。結局、薬の進歩を享受できなくなるのは日本の患者だ」と指摘した。(了)





















※コメント投稿者のブログIDはブログ作成者のみに通知されます