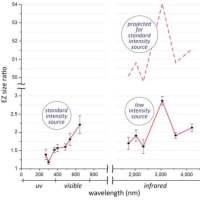
医薬品医療機器総合機構PMDAファイザーのコロナワクチン「コミナティ筋注」添付文書
PMDAの「コミナティ筋注」添付文書には、ワクチンによる増悪(死亡)のリスク、そしてその市販後調査の実施のことは、全く書かれていません。
ワクチンによる増悪(死亡)のリスクの説明を怠ることは、犯罪に近い手口だと思われます。
詳細は、次の記事を参照
ファイザーのコロナワクチン「コミナティ筋注」、「ワクチン接種に伴う疾患増強」を市販後に調査の予定
ほとんどの医師を初めとする医療関係者は、医薬品の添付文書すら読まずに、製薬会社の医薬情報担当者MRが持ってくる宣伝広告パンフレットだけ読み、診療に使用しています。
分かりやすく言えば、嘘と誇張だらけのテレビCMだけを見て投薬する医師がほとんどです。
医薬品の副作用を知っている医師は稀です。
こんなありさまですから、医薬品には副作用はない、という医師や薬剤師も現実にいます。私の周囲にもいます。
ましてや、PMDAのサイトにアクセスする医師はほとんどおらず、ファイザーのコロナワクチン「コミナティ筋注」、「ワクチン接種に伴う疾患増強」を市販後に調査の予定(RMP)という情報にアクセスする医師は皆無です。
医師や薬剤師を信じれば、恐ろしいことになります。
+++++++++++++++++++++++++++++++++++++++++
注
医薬品医療機器総合機構(PMDA)サイトの「医療用医薬品 情報検索」の「一般名・販売名(医薬品の名称)」
https://www.pmda.go.jp/PmdaSearch/iyakuSearch/
の検索ウインドウに、「コミナティ筋注」を入力して検索すると、添付文書、RMP、審査報告書などへのリンクが表示されます(冒頭の図)。
++++++++++++++++++++++++++++++++++++++++++++++++++
PMDAの「コミナティ筋注」添付文書
https://www.pmda.go.jp/PmdaSearch/iyakuDetail/672212_631341DA1025_1_01#HDR_ContraIndications
コミナティ筋注
添付文書番号
631341DA1025_1_01
企業コード
672212
作成又は改訂年月
|
2021年2月改訂(第2版) |
日本標準商品分類番号
876313
薬効分類名
ウイルスワクチン類
承認等
コミナティ筋注
販売名コード
YJコード
631341DA1025
販売名英語表記
COMIRNATY intramuscular injection
販売名ひらがな
こみなてぃきんちゅう
承認番号等
承認番号
30300AMX00231
販売開始年月
2021年2月
貯法・有効期間
貯法
-90~-60℃
有効期間
6ヵ月
基準名
生物学的製剤基準
コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
規制区分
劇薬
特例承認医薬品注1)
注1) 注意―特例承認医薬品
処方箋医薬品注2)
注2) 注意―医師等の処方箋により使用すること
一般的名称
コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
本剤は、本邦で特例承認されたものであり、承認時において長期安定性等に係る情報は限られているため、製造販売後も引き続き情報を収集中である。
本剤の使用にあたっては、あらかじめ被接種者又は代諾者に、本剤に関する最新の有効性及び安全性について文書で説明した上で、予診票等で文書による同意を得た上で接種すること。また、有害事象が認められた際には、必要に応じて予防接種法に基づく副反応疑い報告制度等に基づき報告すること。なお、本剤の製造販売後に収集された情報については、最新の情報を随時参照すること。
- 接種不適当者(予防接種を受けることが適当でない者)
2.1 明らかな発熱を呈している者
2.2 重篤な急性疾患にかかっていることが明らかな者
2.3 本剤の成分に対し重度の過敏症の既往歴のある者[8.4 参照],[9.1.6 参照],[11.1 参照]
2.4 上記に掲げる者のほか、予防接種を行うことが不適当な状態にある者
- 製法の概要及び組成・性状
3.1 製法の概要
SARS-CoV-2ウイルスのスパイクタンパク質のアミノ酸配列をコードするDNAを鋳型として転写したRNAを精製し、脂質成分と混合する。
3.2 組成
コミナティ筋注
|
有効成分 |
トジナメラン |
|
容量 |
0.45mL |
|
含量 |
0.225mg |
|
添加剤 |
[(4-ヒドロキシブチル)アザンジイル]ビス(ヘキサン-6,1-ジイル)ビス(2-ヘキシルデカン酸エステル) 3.23mg |
3.3 製剤の性状
コミナティ筋注
|
pH |
6.9~7.9 |
|
浸透圧 |
425~625mOsm/kg |
|
性状 |
本品は白濁した液である。 |
- 効能又は効果
SARS-CoV-2による感染症の予防
- 効能又は効果に関連する注意
5.1 本剤の予防効果の持続期間は確立していない。
- 用法及び用量
日局生理食塩液1.8mLにて希釈し、1回0.3mLを合計2回、通常、3週間の間隔で筋肉内に接種する。
- 用法及び用量に関連する注意
7.1 接種対象者
本剤の接種は16歳以上の者に行う。
7.2 接種間隔
1回目の接種から3週間を超えた場合には、できる限り速やかに2回目の接種を実施すること。
- 重要な基本的注意
8.1 本剤は「予防接種実施規則」を参照して使用すること。
8.2 被接種者について、接種前に必ず問診、検温及び診察(視診、聴診等)によって健康状態を調べること。[9.1 参照]
8.3 被接種者又はその保護者に、接種当日は過激な運動は避け、接種部位を清潔に保ち、また、接種後の健康監視に留意し、局所の異常反応や体調の変化、さらに高熱、痙攣等の異常な症状を呈した場合には速やかに医師の診察を受けるよう事前に知らせること。
8.4 ショック、アナフィラキシーがあらわれることがあるため、接種前に過敏症の既往歴等に関する問診を十分に行い、接種後一定時間、被接種者の状態を観察することが望ましい。[2.3 参照],[9.1.6 参照],[11.1 参照]
8.5 ワクチン接種直後又は接種後に注射による心因性反応を含む血管迷走神経反射として失神があらわれることがある。失神による転倒を避けるため、接種後一定時間は座らせるなどした上で被接種者の状態を観察することが望ましい。
8.6 本剤と他のSARS-CoV-2に対するワクチンの互換性に関するデータはない。
- 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
- 被接種者が次のいずれかに該当すると認められる場合は、健康状態及び体質を勘案し、診察及び接種適否の判断を慎重に行い、予防接種の必要性、副反応、有用性について十分な説明を行い、同意を確実に得た上で、注意して接種すること。[8.2 参照]
9.1.1 抗凝固療法を受けている者、血小板減少症又は凝固障害を有する者
本剤接種後に出血又は挫傷があらわれることがある。
9.1.2 過去に免疫不全の診断がなされている者及び近親者に先天性免疫不全症の者がいる者
本剤に対する免疫応答が低下する可能性がある。
9.1.3 心臓血管系疾患、腎臓疾患、肝臓疾患、血液疾患、発育障害等の基礎疾患を有する者
9.1.4 予防接種で接種後2日以内に発熱のみられた者及び全身性発疹等のアレルギーを疑う症状を呈したことがある者
9.1.5 過去に痙攣の既往のある者
9.1.6 本剤の成分に対して、アレルギーを呈するおそれのある者
9.2 腎機能障害を有する者
接種要注意者である。
9.3 肝機能障害を有する者
接種要注意者である。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には予防接種上の有益性が危険性を上回ると判断される場合にのみ接種すること。
9.6 授乳婦
予防接種上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中への移行は不明である。
9.7 小児等
16歳未満についての有効性、安全性は確立されていない。
9.8 高齢者
接種にあたっては、問診等を慎重に行い、被接種者の健康状態を十分に観察すること。一般に、生理機能が低下している。
- 副反応
次の副反応があらわれることがあるので、観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
11.1 重大な副反応
- ショック、アナフィラキシー(頻度不明)
本剤の初回接種時にショック、アナフィラキシーが認められた被接種者に対しては、本剤2回目の接種を行わないこと。[2.3 参照],[8.4 参照],[9.1.6 参照]
11.2 その他の副反応
|
5%以上 |
1%~5%未満 |
1%未満 |
|
|
局所症状(注射部位) |
疼痛(84.3%)a)、腫脹(10.6%)a)、発赤・紅斑a) |
そう痒感、熱感、内出血、浮腫 |
|
|
精神神経系 |
頭痛(55.1%)a) |
浮動性めまい、嗜眠、不眠症、顔面麻痺 |
|
|
消化器 |
下痢(15.5%)a) |
嘔吐a)、悪心 |
食欲減退 |
|
呼吸器 |
口腔咽頭痛、鼻閉 |
||
|
筋・骨格系 |
筋肉痛(37.9%)a)、関節痛(23.7%)a) |
四肢痛、背部痛 |
|
|
皮膚 |
多汗症、発疹、寝汗 |
||
|
血液 |
リンパ節症 |
||
|
その他 |
疲労(62.9%)a)、悪寒(32.4%)a)、発熱(14.8%)a) |
疼痛 |
倦怠感、無力症、インフルエンザ様症状 |
a)臨床試験において電子日誌により収集した副反応の発現割合
- 適用上の注意
14.1 薬剤調製時の注意
14.1.1 解凍方法
(1) 冷蔵庫(2~8℃)で解凍する場合は、解凍及び希釈を5日以内に行うこと。
(2) 室温で解凍する場合は、解凍及び希釈を2時間以内に行うこと。
(3) 解凍の際は、室内照明による曝露を最小限に抑えること。直射日光及び紫外線が当たらないようにすること。
(4) 解凍後は再冷凍しないこと。
14.1.2 希釈方法
(1) 希釈前に室温に戻しておくこと。
(2) 本剤は保存料を含まないため、操作にあたっては雑菌が迷入しないよう注意すること。
(3) 本剤のバイアルに日局生理食塩液1.8mLを加え、白色の均一な液になるまでゆっくりと転倒混和すること。振り混ぜないこと。
(4) 希釈前の液は白色の微粒子を含むことがあるが、希釈すると溶解する。希釈後に微粒子が認められる場合には、使用しないこと。
(5) 希釈後の液は6回接種分(1回0.3mL)を有する。デッドボリュームの少ない注射針又は注射筒を使用した場合、6回分を採取することができる。標準的な注射針及び注射筒等を使用した場合、6回目の接種分を採取できないことがある。1回0.3mLを採取できない場合、残量は廃棄すること。
(6) 希釈後の液は2~30℃で保存し、希釈後6時間以内に使用すること。希釈後6時間以内に使用しなかった液は廃棄すること。
(7) 希釈後保存の際には、室内照明による曝露を最小限に抑えること。直射日光及び紫外線が当たらないようにすること。
14.2 薬剤接種時の注意
14.2.1 室温に戻した希釈後のバイアルから接種量0.3mLを取り、微粒子や変色がないことを目視で確認すること。異常が認められる場合は使用しないこと。
14.2.2 通常、三角筋に筋肉内接種すること。静脈内、皮内、皮下への接種は行わないこと。
14.2.3 組織・神経等への影響を避けるため下記の点に注意すること。
(1) 神経走行部位を避けること。
(2) 注射針を刺入したとき、激痛の訴えや血液の逆流がみられた場合は直ちに針を抜き、部位をかえて注射すること。
- 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)第Ⅱ/Ⅲ相パート
12歳以上の健康な参加者を対象に、本剤30µgを19~23日間隔で2回接種したときの有効性及び安全性を検討することを目的として、プラセボ対照無作為化多施設共同試験を実施した。36523例(本剤接種群:18198例、プラセボ接種群:18325例)を対象に、1つ目の主要有効性評価項目である「SARS-CoV-2感染歴がない参加者での2回目接種後7日以降のSARS-CoV-2による感染症に対する本剤の有効性[ワクチン有効性1(VE1)]」を評価した。40137例(本剤接種群:19965例、プラセボ接種群:20172例)を対象に、2つ目の主要有効性評価項目である「SARS-CoV-2感染歴の有無を問わない参加者での2回目接種後7日以降のSARS-CoV-2による感染症に対する本剤の有効性(VE2)」を評価した。解析結果は表1のとおりであった1)。
|
表1 SARS-CoV-2による感染症に対する有効性 |
||||
|
解析対象例数 |
SARS-CoV-2 |
ワクチン有効性 |
||
|
VE1a) |
本剤接種群 |
18198 |
8 |
95.0[90.3, 97.6] |
|
プラセボ |
18325 |
162 |
||
|
VE2a) |
本剤接種群 |
19965 |
9 |
94.6[89.9, 97.3] |
|
プラセボ |
20172 |
169 |
||
|
a)VE1及びVE2の2回目接種後の追跡期間(中央値)はそれぞれ57日と55日であった。また、VE1及びVE2の解析には接種間隔19~42日間の参加者が含まれ、その内訳はVE1とVE2でそれぞれ19~23日間の参加者は96.5%(35248例)と96.3%(38665例)、24~42日間の参加者は3.5%(1275例)と3.7%(1472例)であった2) |
||||
16歳以上の43448例(本剤接種群:21720例、プラセボ接種群:21728例)を対象に本剤接種後の安全性を評価した。一部の参加者(解析対象例数:1回目接種後8183例、2回目接種後7507例)で治験薬接種後7日間、電子日誌により副反応の発現状況を評価した。主な副反応の発現状況(事象全体及びGrade 3以上)は表2のとおりであった1)。注射部位疼痛は接種当日(中央値)に発現し、持続期間は2日(中央値)であった。その他の全身性の事象は接種翌日(中央値)に発現し、持続期間は1日(中央値)であった2)。
|
表2 主な副反応の発現状況 |
|||||||
|
発現例数(発現割合[%]) |
|||||||
|
本剤接種群 |
プラセボ接種群 |
||||||
|
接種回数 |
評価 |
事象全体 |
Grade 3 |
評価 |
事象全体 |
Grade 3 |
|
|
注射部位疼痛 |
1 |
4093 |
3186(77.8) |
28(0.7) |
4090 |
488(11.9) |
2(0.0) |
|
2 |
3758 |
2730(72.6) |
33(0.9) |
3749 |
372(9.9) |
0(-) |
|
|
疲労 |
1 |
4093 |
1700(41.5) |
35(0.9) |
4090 |
1172(28.7) |
14(0.3) |
|
2 |
3758 |
2086(55.5) |
143(3.8) |
3749 |
756(20.2) |
16(0.4) |
|
|
頭痛 |
1 |
4093 |
1413(34.5) |
25(0.6) |
4090 |
1100(26.9) |
22(0.5) |
|
2 |
3758 |
1732(46.1) |
76(2.0) |
3749 |
735(19.6) |
19(0.5) |
|
|
筋肉痛 |
1 |
4093 |
738(18.0) |
14(0.3) |
4090 |
398(9.7) |
5(0.1) |
|
2 |
3758 |
1260(33.5) |
63(1.7) |
3749 |
260(6.9) |
4(0.1) |
|
|
悪寒 |
1 |
4093 |
434(10.6) |
9(0.2) |
4090 |
203(5.0) |
3(0.1) |
|
2 |
3758 |
1114(29.6) |
62(1.6) |
3749 |
125(3.3) |
0(-) |
|
|
関節痛 |
1 |
4093 |
406(9.9) |
7(0.2) |
4090 |
247(6.0) |
1(0.0) |
|
2 |
3758 |
772(20.5) |
27(0.7) |
3749 |
170(4.5) |
5(0.1) |
|
|
発熱c) |
1 |
4093 |
111(2.7) |
8(0.2) |
4090 |
27(0.7) |
7(0.2) |
|
2 |
3758 |
512(13.6) |
32(0.9) |
3749 |
14(0.4) |
3(0.1) |
|
|
a)電子日誌により評価した例数 |
|||||||
17.1.2 国内第Ⅰ/Ⅱ相試験(C4591005試験)
20歳以上85歳以下の日本人健康成人を対象に、本剤30µgを19~23日間隔で2回接種したときの安全性、忍容性及び免疫原性を検討することを目的として、プラセボ対照試験を実施した。
156例(本剤接種群:116例、プラセボ接種群:40例)を対象に免疫原性を評価し、2回目接種後1ヵ月のSARS-CoV-2血清中和抗体価は表3のとおりであった。
|
表3 2回目接種後1ヵ月のSARS-CoV-2血清中和抗体価(50%中和抗体価) |
||||
|
測定例数 |
GMT[両側95%CI]a) |
GMFR[両側95%CI]a) |
||
|
本剤接種群 |
全年齢 |
116 |
524.5[459.7, 598.4] |
51.5[45.2, 58.7] |
|
20~64歳 |
94 |
570.7[497.6, 654.5] |
55.8[48.7, 63.9] |
|
|
65~85歳 |
22 |
365.6[254.6, 525.0] |
36.6[25.5, 52.5] |
|
|
プラセボ接種群 |
全年齢 |
40 |
10.6[9.8, 11.4] |
1.1[1.0, 1.1] |
|
CI:信頼区間、GMFR:幾何平均上昇倍率、GMT:幾何平均抗体価 |
||||
160例(本剤接種群:119例、プラセボ接種群:41例)を対象に本剤接種後の安全性を評価した。治験薬接種後7日間は電子日誌により副反応が収集され、主な副反応の発現状況(事象全体及びGrade 3以上)は表4のとおりであった。注射部位疼痛は接種当日から翌日(中央値)の間に発現し、持続期間は2日(中央値)であった。その他の全身性の事象は接種翌日(中央値)に発現し、持続期間は1日(中央値)であった3)。
|
表4 主な副反応の発現状況 |
|||||
|
発現例数(発現割合[%]) |
|||||
|
本剤接種群 |
プラセボ接種群 |
||||
|
接種回数 |
事象全体 |
Grade 3 |
事象全体 |
Grade 3 |
|
|
注射部位疼痛 |
1 |
103(86.6) |
2(1.7) |
1(2.4) |
0(-) |
|
2 |
92(79.3) |
2(1.7) |
0(-) |
0(-) |
|
|
疲労 |
1 |
48(40.3) |
1(0.8) |
4(9.8) |
0(-) |
|
2 |
70(60.3) |
4(3.4) |
1(2.4) |
0(-) |
|
|
頭痛 |
1 |
39(32.8) |
1(0.8) |
6(14.6) |
0(-) |
|
2 |
51(44.0) |
2(1.7) |
5(12.2) |
0(-) |
|
|
筋肉痛 |
1 |
17(14.3) |
0(-) |
1(2.4) |
0(-) |
|
2 |
19(16.4) |
0(-) |
0(-) |
0(-) |
|
|
悪寒 |
1 |
30(25.2) |
1(0.8) |
2(4.9) |
0(-) |
|
2 |
53(45.7) |
2(1.7) |
1(2.4) |
0(-) |
|
|
関節痛 |
1 |
17(14.3) |
1(0.8) |
2(4.9) |
0(-) |
|
2 |
29(25.0) |
1(0.9) |
0(-) |
0(-) |
|
|
発熱b) |
1 |
17(14.3) |
0(-) |
0(-) |
0(-) |
|
2 |
38(32.8) |
1(0.9) |
0(-) |
0(-) |
|
|
a)重症度が「高度(日常活動を妨げる)」以上として報告された事象 |
|||||
- 薬効薬理
18.1 作用機序
本剤に含有される修飾ウリジンメッセンジャーRNA(mRNA)は脂質ナノ粒子に封入されており、それにより非複製性であるmRNAが宿主細胞に取り込まれ、mRNAにコードされるSARS-CoV-2のスパイクタンパク質が一過性に発現する。本剤接種によりスパイクタンパク質に対する中和抗体産生及び細胞性免疫応答が誘導されることで、SARS-CoV-2による感染症の予防に寄与すると考えられている。
- 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 本剤は、医薬品医療機器等法第14条の3第1項の規定に基づき承認された特例承認品目であり、承認時において長期安定性等に係る情報は限られているため、製造販売後も引き続き情報を収集し、報告すること。
21.3 現時点での知見が限られていることから、製造販売後、副作用情報等の本剤の安全性に関するデータを、あらかじめ定めた計画に基づき早期に収集するとともに、独立行政法人医薬品医療機器総合機構に提出し、本剤の適正使用に必要な措置を講じること。その際、国が実施する健康調査等により得られた情報についても適切に反映すること。
21.4 現在国内外で実施中又は計画中の臨床試験の成績が得られた際には、速やかに当該成績を独立行政法人医薬品医療機器総合機構に提出するとともに、本剤の有効性及び安全性に係る最新の情報を、医療従事者及び被接種者が容易に入手可能となるよう必要な措置を講じること。また、国が行う本剤の有効性及び安全性に係る情報の発信について、適切に協力すること。
21.5 本剤の接種に際し、本剤の有効性及び安全性については今後も情報が集積されることを踏まえ、あらかじめ被接種者又は代諾者に最新の有効性及び安全性に関する情報が文書をもって説明され、予診票等で文書による同意を得てから接種されるよう、医師に対して適切に説明すること。
21.6 医薬品医療機器等法施行規則第41条に基づく資料の提出の猶予期間は、承認取得から起算して6ヵ月とする。上記21.2、21.3又は21.4に基づいて提出された資料等により、承認事項を変更する必要が認められた場合には、医薬品医療機器等法第74条の2第3項に基づき承認事項の変更を命ずることがあること。
- 包装
195バイアル
- 主要文献
1) 社内資料:海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)(2021年2月承認 CTD2.5.1.2、2.5.4.3、2.5.5.5、2.5.5.7、2.7.6.3)
2) 社内資料:海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)補助資料
3) 社内資料:国内第Ⅰ/Ⅱ相試験(C4591005試験)補助資料
- 文献請求先及び問い合わせ先
ファイザー株式会社
〒151-8589 東京都渋谷区代々木3-22-7
新型コロナウイルスワクチン専用ダイヤル 0120-146-744
FAX 03-3379-3053
- 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
- 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7
26.2 技術提携
BIONTECH