蚊などの昆虫・節足動物によって媒介される感染症のうち、デング熱やマラリアなど今だに予防ワクチンが存在しないものが多い。このような感染症を防ぐためには媒介者となる昆虫の発生を抑えることが最も重要だが、これまでは主に殺虫剤がこの目的に用いられてきた。しかし近年、遺伝子組換え技術等を利用して旧来の技術とは異なるアプローチから感染症を媒介する有害な蚊を防除するという試みがなされようとしている。以前にも何度か紹介したRIDL(Release of Insects carrying a Dominant Lethal)と呼ばれる方法では、優性致死遺伝子を持つオスの蚊を放飼してその遺伝子が遺伝した次世代の個体を死滅させる。基本的な原理は不妊虫放飼法と同じだが、この方法では理論的には野外の個体数が減少すればしていくほど加速度的にその効果を増して行く。
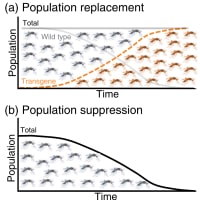
個体群置き換え法
RIDL法は有害生物の個体数を直接削減することを目指すが、これらとはまた違った発想で蚊による病気の媒介を防ごうとするアイデアもある。“個体群置き換え法(population replacement)”と呼ばれているが(この日本語への訳は筆者によるもので正確なものかどうかは保証しない)、これは蚊の個体群の中に病原体の媒介を妨げるような遺伝因子を広げることで病気の蔓延を防ぐというものだ。“個体群置き換え”といっても野外の個体群そのものをそっくり別のものに置き換えてしまうというイメージは誤りで、実際には染色体の一部の領域や細胞質など特定の遺伝因子が集団中で置き換わるという理解が正しい。不妊虫放飼法との大きな違いは、不妊虫放飼法は蚊の個体群のサイズを減らすことが目的であるのに対し、個体群置き換え法では個体群のサイズは変わらないか著しく減少することが無い。その代わりに特定の(人間にとって)望ましい遺伝因子の頻度を上昇させ、究極的にはそれを個体群中に固定させる。この方法がうまく行けば、蚊は相変わらず不愉快な存在として残り続けるがもはや病気を媒介する恐ろしい存在ではなくなるので、公衆衛生上の目標は達成できることになる。

(from Alphey 2009)
RIDL法と比べ個体群置き換え法には以下に述べるような利点がある。RIDL法は野外の個体群を縮小させるが、放飼する雄は同じ種のメスとしか交尾しないため原理的にその効果は単一の種の単一の生殖集団に限定される。しかし、病原体は宿主として幾つかの異なる種や亜種を利用している場合がある。この主たる例はマラリアだろう。アフリカでやマラリアは主にガンビエハマダラカという種が媒介するが、この種には形態的に区別できない複数の亜種が存在する。また、その亜種と認識されている集団自体もさらに同所的に存在する異なる分集団に分かれていることが分かっている。このように媒介者となる種(あるいは生殖集団)が複数存在する場合、一つのターゲットを不妊虫放飼法で駆逐しても、その空いたニッチを埋めるように別の種の個体群が拡大してしまう恐れがある。そうなると病気は一時的には減るかもしれないが、拡大した別の媒介者によってまたぶり返し、場合によってはもっと状況は悪くなるかもしれない。実際、遺伝子組換えによるネッタイシマカの不妊化技術を開発しているオキシテック社も、彼らの方法ではマラリアの抑制は難しいと認めている。一方で、個体群置き換え法では、蚊の種構成自体にはあまり影響を与えないと考えられるので、主要な媒介種か集団をターゲットにして行えばそのような問題は起きにくいと考えられる。
病原体の媒介を防ぐ目的で蚊の個体群に広める遺伝因子(エフェクター)には例えば次のようなものが考えられる。
1.蚊の体内で病原体の増殖を抑える遺伝子
実際に自然にいるの蚊の中から彼らが媒介する病原体に対して“抵抗性”になる遺伝子が見つかっている。また本来自然界に無い遺伝子でも人間が“デザイン”して新たに作り出すことも考えられている。
2.媒介者である蚊の成虫寿命を縮めるような遺伝子因子
蚊は吸血という行動によって我々の病原体を媒介するが、一匹の蚊がある病気に関して一人の新たな感染者を出すためには最低でも2回の吸血を必要とする。なぜならば最初に吸血で感染した人間の血液から病原体を獲得して、それ以降の吸血ではじめて別の人間に病原体の入った唾液を注入することができるからだ。また、病原体にも蚊の体内に入ってから感染できる状態になるまでに要する一定の期間が存在する(外部潜伏期間:extrinsic incubation period)。例えばデングウィルスでは、温度にも依存するが蚊に吸血されてから次に人間に感染できるようになるまでには7~14日の期間が必要で、宿主である蚊のメスには最低でもこの期間を生き抜いてもらえなければ感染を広めることができない。
あくまで感染を広めない程度に成虫寿命を縮めるという性質は、次の理由で個体群置き換え法で用いるエフェクターの性質として望ましい。もし、エフェクターが最初の吸血と産卵も許さないぐらいに苛烈なものであれば、その遺伝因子を持った個体の適応度はゼロになってしまうだろう。これでは個体群に広まるどころか速やかに消失してしまうので致死遺伝子と実質的には変わらない。一方で最初の産卵は行える程度に穏やかなものであれば、とりあえずは次世代に伝わることができる。もちろん成虫寿命を縮めるという性質も著しく適応度を奪うはずだが、そのエフェクター遺伝因子が後に述べるような“利己的性”を兼ね備えていれば個体群中で頻度を増して消失せず維持される可能性がある。
実際に自然にいるの蚊の中から彼らが媒介する病原体に対して“抵抗性”になる遺伝子が見つかっている。また本来自然界に無い遺伝子でも人間が“デザイン”して新たに作り出すことも考えられている。
2.媒介者である蚊の成虫寿命を縮めるような遺伝子因子
蚊は吸血という行動によって我々の病原体を媒介するが、一匹の蚊がある病気に関して一人の新たな感染者を出すためには最低でも2回の吸血を必要とする。なぜならば最初に吸血で感染した人間の血液から病原体を獲得して、それ以降の吸血ではじめて別の人間に病原体の入った唾液を注入することができるからだ。また、病原体にも蚊の体内に入ってから感染できる状態になるまでに要する一定の期間が存在する(外部潜伏期間:extrinsic incubation period)。例えばデングウィルスでは、温度にも依存するが蚊に吸血されてから次に人間に感染できるようになるまでには7~14日の期間が必要で、宿主である蚊のメスには最低でもこの期間を生き抜いてもらえなければ感染を広めることができない。
あくまで感染を広めない程度に成虫寿命を縮めるという性質は、次の理由で個体群置き換え法で用いるエフェクターの性質として望ましい。もし、エフェクターが最初の吸血と産卵も許さないぐらいに苛烈なものであれば、その遺伝因子を持った個体の適応度はゼロになってしまうだろう。これでは個体群に広まるどころか速やかに消失してしまうので致死遺伝子と実質的には変わらない。一方で最初の産卵は行える程度に穏やかなものであれば、とりあえずは次世代に伝わることができる。もちろん成虫寿命を縮めるという性質も著しく適応度を奪うはずだが、そのエフェクター遺伝因子が後に述べるような“利己的性”を兼ね備えていれば個体群中で頻度を増して消失せず維持される可能性がある。
エフェクターを広める手段
個体群置き換え法の最大の難関は、エフェクターとなる遺伝因子をどのようにして個体群中に広めるかという問題だ。理論的にはそのような遺伝因子を持った個体を放飼し続ければ次第に個体群中に頻度が上がっていくかもしれないが、仮にその遺伝因子が蚊の適応度にとって中立であったとしても、野外の巨大な個体群を置き換えるには途方も無い数の蚊を飼育し放飼しなければならないだろう。また、往々にしてエフェクターとなるような遺伝子因子は蚊にとっても有害である可能性が高く個体群中に安定に維持されないかもしれない。
この問題を解決するために、“利己的な遺伝因子”をエフェクター遺伝子を広める“ドライバー”として利用することが考えられている(Sinkins and Gould 2006)。利己的な遺伝子因子と呼ぶと、リチャード・ドーキンスのかのベストセラーのタイトルを思い出す人も多いかもしれないが、ここで言う“利己的”であるということは若干意味が異なる。ドーキンスが彼の本で用いた“利己的性”とは、あらゆる遺伝子は自身のコピーを広めるという自己利益のために進化するという意味だろう。個体の適応度を上げるという一般的な遺伝子の作用もその利己的性の現れである。しかし、一般的に生物学の論文などで“利己的な”という言葉が改まって使用される場合はもう少し限定された性質を指すようだ。この場合、利己的遺伝因子は、個体の適応度に全く寄与しないかあるいは減少させもするが、それでも自身の存在を個体群中に広めていく性質を持っている遺伝因子のことである。利己的因子は自律的に自身の頻度を個体群中に広める性質があるので、エフェクターとなる遺伝因子をこのような因子と連鎖させて導入すれば、ヒッチハイキングによって個体群中に広めることができると期待される。利己的因子のよく知られている例としては、次のようなものがある。
1.ドライブを引き起こす遺伝因子
転移因子、ホーミングエンドヌクレアーゼ遺伝子(Homing Endonuclease Genes:HEGs)、分離歪曲因子(Segregation Distorter:SD)のような遺伝子因子は、自身の次世代への伝達率をメンデルの遺伝法則から期待される分離比よりも高くする性質がある。このような現象はドライブと呼ばれている。これらの因子を行様な遺伝子を広げるドライバーとして用いる利点はそれ自身が自律的に個体群中に広まっていくため、放飼する数が少数で済むこと、また多少個体の適応度に負の影響があっても安定的に維持されうることだ。しかし、途中でドライバーとエフェクター遺伝子の間で組み換えが起こった場合、ドライブバーだけが単独で広まっていくという恐れがある。この問題は、エフェクター遺伝子に強い負の適応度への効果がる場合は特に懸念されるだろう。またドライバーそれ自体にも適応度へ強い負の影響があった場合、ドライブバーが淘汰されるか標的とする個体群中でドライバーのドライブ効果に対する抵抗性が発達する可能性も考えられる。
2.Underdominance
ある二つの対立遺伝子のペアにおいて、そのヘテロ接合体の適応度がそれぞれのホモ接合体の適応度と比べて高い場合、それらの対立遺伝子は超優勢(Overdomminance)の関係にあると呼ばれる。超優勢の関係にある二つの対立遺伝子は機会的浮動による消失をお互いに免れながら長期間個体群中に維持されることで知られる。それに対して、ヘテロ接合体の適応度がそれぞれのホモ接合体の適応度と比べて低い場合、それらの対立遺伝子はUnerdomminance(正確な日本語訳は見つからなかった。)の関係にあるという。Undedominanceの関係にある二つの対立遺伝子は、超優勢とは逆に最終的にはどちらか一方の対立遺伝が個体群中から消失する運命にある。どちらの対立遺伝子が消失するかはそれぞれのホモ接合体での適応度と存在比によるが、一般的に初期頻度が低い対立遺伝子が消失に向かって推移することになる。なぜならば、頻度の低い方の対立遺伝子はヘテロ接合体として存在する割合がより高いからだ。
Underdominanceのような関係は進化的に不安定なので、そのような関係にある遺伝子が自然界に見つかることは殆ど無いだろう。ただ、人間が野生型の対立遺伝子とUnderdominanceとなるような遺伝因子をデザインすることは可能だ。厳密に言えば、underdominance因子は利己的遺伝因子とは言えないかもしれない。なぜならば初期頻度が低い状態では自身を滅ぼす方向に働く自殺遺伝子でしか無いからだ。しかし、一旦この因子が野生型の対立遺伝子の頻度にたいして一定の比率を超えると、一転して相手を消滅させように作用する。
Underdominanceを利用した戦略は、野生型の対立遺伝子を上回るまでかなり多くの個体数を放飼しなければならないため、大きな集団に大しては用いることはできないだろう。しかし、この方法には次のような利点がある。ドライブ効果をもつ遺伝因子のような存在比に関わらず自律的に広まっていく因子の場合、標的としている個体群の外部の集団にも漏れ出して、最終的に人間がその蔓延をコントロールすることが出来なくなる恐れがある。一方で、underdominance因子は標的としていない別の集団に移入しても、その集団中での頻度は低いため、そこではすぐに消失する。一方で一旦固定した集団中では外部から移入する野生型の対立遺伝子を排除するように働くため安定的に維持される。
3.ボルバキア
ボルバキア(Wolbachia)は節足動物と線虫類に広く見られる細胞内共生細菌である。この細菌の興味深い点はその自身の感染を宿主の個体群中に広めていく生存戦略にある。ボルバキアは基本的にはミトコンドリアと同様、細胞質を通じた母系遺伝のみで次世代に伝わっていく(ただしボルバキアが系統的に全く異なる生物種に存在していることは、進化的な時間スケールではごくたまに生物種間の水平伝搬が起こっていることを意味している)。したがって雄に遺伝してしまったボルバキアは次世代に伝わる事ができないのだが、細胞質不和合性という次に述べる性質で間接的に自身の蔓延に寄与することができる。あるボルバキアを持ったオスが、ボルバキアを持たいない(あるいは自分より劣位にある異なるタイプのボルバキアを持った)メスと交尾した場合、その子孫は正常に発育せずに死んでしまう。一方で、このようなオスが自身と同じタイプのボルバキアを持つメスと交尾した場合には、その子孫は通常通り孵化し生存する。このようなオス個体に感染したボルバキアの振る舞いは、自分と同じボルバキアが存在しない細胞質を集団中からひとつひとつ排除しているようなもので、長期的にはそのボルバキアの感染が個体群中に広まっていくことになる。ボルバキア は系統や宿主によっては細胞質不和合性の他にも、オス殺し、宿主のメス化、単為生殖の誘導などといった多様な性質が見られ、それらは全てボルバキア自身の感染を広めていくために理にかなった戦略である。
ボルバキアが最初に発見された生物はアカイエカという種類の蚊であるが、感染症媒介者として重要な蚊種でデング熱・黄熱病を媒介するネッタイシマカとマラリアを媒介するハマダラカ類からはいずれもボルバキア は見つかっていない。標的とする集団にボルバキアが存在しないことは、個体群置き換え法においては好都合であるだろう。なぜならば、既に野生のボルバキアが感染している集団に新たな我々にとって望ましいボルバキアを広げることは容易ではなく、場合によってその蔓延を阻止する要因になりかねないからだ。
転移因子、ホーミングエンドヌクレアーゼ遺伝子(Homing Endonuclease Genes:HEGs)、分離歪曲因子(Segregation Distorter:SD)のような遺伝子因子は、自身の次世代への伝達率をメンデルの遺伝法則から期待される分離比よりも高くする性質がある。このような現象はドライブと呼ばれている。これらの因子を行様な遺伝子を広げるドライバーとして用いる利点はそれ自身が自律的に個体群中に広まっていくため、放飼する数が少数で済むこと、また多少個体の適応度に負の影響があっても安定的に維持されうることだ。しかし、途中でドライバーとエフェクター遺伝子の間で組み換えが起こった場合、ドライブバーだけが単独で広まっていくという恐れがある。この問題は、エフェクター遺伝子に強い負の適応度への効果がる場合は特に懸念されるだろう。またドライバーそれ自体にも適応度へ強い負の影響があった場合、ドライブバーが淘汰されるか標的とする個体群中でドライバーのドライブ効果に対する抵抗性が発達する可能性も考えられる。
2.Underdominance
ある二つの対立遺伝子のペアにおいて、そのヘテロ接合体の適応度がそれぞれのホモ接合体の適応度と比べて高い場合、それらの対立遺伝子は超優勢(Overdomminance)の関係にあると呼ばれる。超優勢の関係にある二つの対立遺伝子は機会的浮動による消失をお互いに免れながら長期間個体群中に維持されることで知られる。それに対して、ヘテロ接合体の適応度がそれぞれのホモ接合体の適応度と比べて低い場合、それらの対立遺伝子はUnerdomminance(正確な日本語訳は見つからなかった。)の関係にあるという。Undedominanceの関係にある二つの対立遺伝子は、超優勢とは逆に最終的にはどちらか一方の対立遺伝が個体群中から消失する運命にある。どちらの対立遺伝子が消失するかはそれぞれのホモ接合体での適応度と存在比によるが、一般的に初期頻度が低い対立遺伝子が消失に向かって推移することになる。なぜならば、頻度の低い方の対立遺伝子はヘテロ接合体として存在する割合がより高いからだ。
Underdominanceのような関係は進化的に不安定なので、そのような関係にある遺伝子が自然界に見つかることは殆ど無いだろう。ただ、人間が野生型の対立遺伝子とUnderdominanceとなるような遺伝因子をデザインすることは可能だ。厳密に言えば、underdominance因子は利己的遺伝因子とは言えないかもしれない。なぜならば初期頻度が低い状態では自身を滅ぼす方向に働く自殺遺伝子でしか無いからだ。しかし、一旦この因子が野生型の対立遺伝子の頻度にたいして一定の比率を超えると、一転して相手を消滅させように作用する。
Underdominanceを利用した戦略は、野生型の対立遺伝子を上回るまでかなり多くの個体数を放飼しなければならないため、大きな集団に大しては用いることはできないだろう。しかし、この方法には次のような利点がある。ドライブ効果をもつ遺伝因子のような存在比に関わらず自律的に広まっていく因子の場合、標的としている個体群の外部の集団にも漏れ出して、最終的に人間がその蔓延をコントロールすることが出来なくなる恐れがある。一方で、underdominance因子は標的としていない別の集団に移入しても、その集団中での頻度は低いため、そこではすぐに消失する。一方で一旦固定した集団中では外部から移入する野生型の対立遺伝子を排除するように働くため安定的に維持される。
3.ボルバキア
ボルバキア(Wolbachia)は節足動物と線虫類に広く見られる細胞内共生細菌である。この細菌の興味深い点はその自身の感染を宿主の個体群中に広めていく生存戦略にある。ボルバキアは基本的にはミトコンドリアと同様、細胞質を通じた母系遺伝のみで次世代に伝わっていく(ただしボルバキアが系統的に全く異なる生物種に存在していることは、進化的な時間スケールではごくたまに生物種間の水平伝搬が起こっていることを意味している)。したがって雄に遺伝してしまったボルバキアは次世代に伝わる事ができないのだが、細胞質不和合性という次に述べる性質で間接的に自身の蔓延に寄与することができる。あるボルバキアを持ったオスが、ボルバキアを持たいない(あるいは自分より劣位にある異なるタイプのボルバキアを持った)メスと交尾した場合、その子孫は正常に発育せずに死んでしまう。一方で、このようなオスが自身と同じタイプのボルバキアを持つメスと交尾した場合には、その子孫は通常通り孵化し生存する。このようなオス個体に感染したボルバキアの振る舞いは、自分と同じボルバキアが存在しない細胞質を集団中からひとつひとつ排除しているようなもので、長期的にはそのボルバキアの感染が個体群中に広まっていくことになる。ボルバキア は系統や宿主によっては細胞質不和合性の他にも、オス殺し、宿主のメス化、単為生殖の誘導などといった多様な性質が見られ、それらは全てボルバキア自身の感染を広めていくために理にかなった戦略である。
ボルバキアが最初に発見された生物はアカイエカという種類の蚊であるが、感染症媒介者として重要な蚊種でデング熱・黄熱病を媒介するネッタイシマカとマラリアを媒介するハマダラカ類からはいずれもボルバキア は見つかっていない。標的とする集団にボルバキアが存在しないことは、個体群置き換え法においては好都合であるだろう。なぜならば、既に野生のボルバキアが感染している集団に新たな我々にとって望ましいボルバキアを広げることは容易ではなく、場合によってその蔓延を阻止する要因になりかねないからだ。
ボルバキアを利用したデング熱の抑圧
蚊に対する個体群置き換え法では、ボルバキアを用いた方法が現段階で最も実用に近付いている方法かもしれない。
豪クィーンズランド大学のScott L. O’Neillらのグループは2009年に、ネッタイシマカにポップコーン(wMelPop)と呼ばれるボルバキアの系統を感染させることに成功したとSience誌に報告した(McMeniman et al. 2009)。wMelPopは遺伝的に脳細胞が変性して成虫寿命が短くなる性質を示すあるショウジョウバエの系統から見つかったボルバキアだが(脳細胞の中で増殖したボルバキアの電顕像がまるで袋に詰まったポップコーンのようだからこのような名前が付いた)、この系統の短い成虫寿命の原因がwMelPopの感染であることが分かっていた(Min and Benzer 1997)。前述したように蚊の成虫寿命を短縮することはデングウィルスのような病原体の感染効率を大きく損なう。彼らはこのwMelPopの成虫寿命に対する効果がヒトスジシマカでも得られると期待したのだが、実際にヒトスジシマカでも同じように宿主の成虫寿命を著しく短縮することが分かった。
wMelPopを個体群置き換え法に用いるアイデアで興味深い点は、それ自身がドライバーでありエフェクターでも有るということだ。これはわざわざ遺伝子組換え技術を使って新たなエフェクター遺伝子を導入する必要が無いという点で、社会的にも受け入れられやすいという利点があるかもしれない(ただし、それを以てして環境に優しいと言えるかというと個人的には疑問だけど)。
同じ年に、wMelPopの持つもう一つの意義深い作用が同じグループから報告された。wMelPopに感染したヒトスジシマカでは、デングウィルスの蚊の体内での増殖が抑制されるということが明らかとなった(Moreira et al. 2009)。このボルバキアのウィルスの増殖を阻止するメカニズは今のところ分かっていないが、本来の宿主のショウジョウバエにおいても同様にRNAウィルスの増殖が阻止されるらしく、いくつかの致死的なウィルスの作用から宿主を保護していることが分かっている。
前述したように、ボルバキアは宿主の繁殖機会をときに奪いながらも自身を個体群中に広めていくという意味で利己的な存在である。しかし、基本的に垂直伝搬のみでしか次代に受け継がれるチャンスがないことを考えると、宿主の生存力を奪う事は自体は彼らにとってなんの利益にもならないだろう。実際、線虫のフィラリアや昆虫のトコジラミ(Hosokawa et al. 2010)など、一部の生物ではボルバキアが宿主相利共生となっている例もある。wMelPopに見られたウィルスの増殖を阻む作用も、宿主の生存力を上げることにより自身の蔓延をさらに広げるという“利己的でない”生存戦略の一つなのかもしれない。
wMelPop の持つ成虫寿命の短縮作用はデングウィルスの流行を阻止する上では望ましいが、同時に蚊個体の適応度に直接影響するようなこのボルバキアの性質は、蔓延速度を遅らせるか場合によってはそれ自体を実現不可能にするという意味で諸刃の刃でもある。厄介なことに、wMelPop のヒトスジシマカの適応度への作用は成虫寿命の短縮にとどまら無いらしい。ヒトスジシマカを含むシマカ類の卵は、乾燥した状態で孵化せずに長期間耐得ることができる。降雨等によってたまった水にふれるとその刺激で孵化が誘導される。幼虫の好適な生育環境が整うまで孵化を遅らせるという一種の休眠だ。wMelPopに感染したヒトスジシマカではこの耐久卵の孵化率が著しく下がることが分かった(McMeniman and O'Neill 2010)。
ボルバキア自体がデングウィルスの増殖を抑えて実質的に媒介能力を奪うとわかった以上、当初注目されていた成虫寿命の短縮効果は不要で、むしろお荷物ということになる。そこでO’NeillらはwMelPopとは別のボルバキアでウィルスの増殖阻止効果だけを持つより理想的な系統を探すことにした。彼らが注目したのは、同じくショウジョウバエのボルバキアでwMelという系統だ。このボルバキアは現在自然界に生息しているショウジョウバエで最も頻繁に見つかるタイプのボルバキアだが、このボルバキアはほんのここ100年間の間にその勢力を拡大したと考えられている(Riegler et al. 2005)。
wMelはwMelPopと異なり感染した宿主のネッタイシマカ成虫寿命を短くすることはなく、耐久卵の孵化率も減少していなかった。wMelの宿主への影響がwMelPopと比べて穏やかなのは、蚊体内での増殖能力の違いにあると考えれられる。wMelPopは全身の様々な組織の細胞で増殖が見られたが、wMelは卵巣以外の組織の細胞ではそれほど増えていなかった。wMelPopの宿主への有害作用にはどのような意味があるのかわからないが、全てのボルバキアに共通する性質というわけでは無いようだ。一方で、wMelの感染したネッタイシマカでは、wMelPopの時と同様にデングウィルスの増殖が1500分の一に抑え抑えられていた。(デングウィルス4つの血清型が存在するが、この実験で用いられたのは2型だった。他の型のデングウィルスに関してはどうなのだろう?)。また、wMelの感染した蚊の唾液からはデングウィスルスは検出されなかった。デングウィルスは蚊の唾液と共に人間の血液に注入されるため、このウィルスが蚊の唾液まで移行できていないということは、その感染能力が完全に奪われていることを意味する(しかし、残念ながら媒介能力に関する直接的な検証はされていないみたい)。
上記の研究が報告されたNatureの同じ号の論文で、O’NeillらはwMelが実際にネッタイシマカの野外集団に浸潤して固定することができるかどうかを野外集団について確かめる実験を行ったことを報告している。この実験が行われた場所は豪ケアンズにほど近いヨーキーズとゴードンベールという場所だが、どちらも600世帯余りの小さな集落のようだ。デング熱を媒介しないといっても血を吸うメス成虫(しかもわけの分からない細菌が感染した)を放飼しなければならない実験なので、よくこれが実現したなと思うが、"長期に渡る地元住人との交流の末、強い支持を得た(an extensive period of community engagement and subsequent strong community support)"らしい。
実験では10週間で合計30万匹のwMelに感染した蚊が放飼された。どちらの地区でも放飼開始から感染蚊の割合が上昇し、終了の時点ではその地区で捕獲される蚊の約7割以上が感染している状態になっていたが、放飼をやめてからも徐々にその感染率は伸び続け、放飼終了から5週目あたりで感染率9割に達した。
10週間で約30万匹という数字がどれだけの労力を必要とするのか全く想像もできないが、今回実験が行われた集落の規模から考えると意外に多いんだなという感じがした。やはりボルバキアと云えども短期間で広めるためにはかなりの初期頻度を必要とするのだろう。RIDL法ではオスだけを放飼すれば良いが、今回の場合はボルバキアを次代に遺伝させるメスも放飼する必要がある。病気は媒介しないといえ、血を吸う不愉快なメスの蚊をわざわざ大量に撒くということに地元の理解を得るのはそう簡単なことではなさそうだ。実際に広い地域に応用するためには、あらかじめ殺虫剤やRIDL法で個体群のサイズを下げておくといったように、他の方法と組み合わせて行う必要があるかもしれない。
ボルバキアを利用した蚊媒介性感染症の抑制は、デングウィルスだけではなくマラリアにも応用できるかもしれない。今年発表されたHughesら(2011)の研究によると、ボルバキアを感染させたガンビエハマダラカでは、マラリア原虫のオーシスト形成が阻害されることが分かった。残念ながら安定的にボルバキアが継承される感染系統を作り出すことにはまだ今のところ成功していないようだが、今後の発展が期待される。
ボルバキアを用いることの懸念
個体群置き換え法は前述したように、媒介宿主の個体群のサイズに影響を与えないという点でRIDL法よりも優れているかもしれない。また、一度置き換えが成功してしまえば、その後人間が特に手を加えなくとも安定的にその状態が維持されるということも魅力的である。
しかし、この方法がRIDLと比べて環境に優しくより倫理的であるかというと必ずしもそうは言えないだろう。個体群置き換え法は、本来自然界に存在しない遺伝因子(ボルバキアも広義には一種の遺伝因子とみなすことができる)を野外個体群に導入するが、RIDL法と根本的に異なるのは、この遺伝因子が長期間あるいは永久的に自然界に維持されることである。そして、一度広めてしまったそのような遺伝因子を再び消滅させてもとの状態に戻すことは非常に困難であると思われる。一方で、RIDL法で用いる致死遺伝子は放飼を止めれば原理的には速やかに個体群から消滅するだろう。だから何か予期しない問題が生じてもまた後戻りできるという可能性は高い。この意味において、たとえボルバキアという遺伝子組み換え技術を用いていない場合でも個体群置き換え法の倫理的なハードルはRIDLと変わらないか、むしろそれ以上に高いと私は考える。
もちろん、たとえ倫理的な問題を孕んでいたとしてもそれによってデング熱で苦しむ人々が減ることの意義を忘れてはならない。しかし、個体群置き換え法が本当に永久的な解決になるのかどうかということも今のところまだ不透明だ。デングウィルスにとって人間に感染することができないという状態は非常に強い選択圧になるだろうが、このウィルスがwMelの作用を乗り越えるような進化をすることができないという保証はどこにもない。もしそのようなウィルスが新たに生じるか、もしくは既に少頻度で存在していると、デング熱は一時的に抑制されるた後にまた振り返すことになるだろう。もしそうなってしまっても、もう一旦広めてしまったボルバキアを個体群から除去することは難しい。デングウィルスがボルバキアの効果に打ち勝つことができるかどうかは今のところまだ分からないが、少なくともなぜこの細菌がウィルスの増殖を抑えることができるのかというメカニズムを解明しておく必要はあると思う。
Alphey, L. (2009). "Natural and engineered mosquito immunity." J Biol 8(4): 40.
Hosokawa, T., R. Koga, et al. (2010). "Wolbachia as a bacteriocyte-associated nutritional mutualist." Proc Natl Acad Sci U S A 107(2): 769-774.
Hoffmann, A. A., B. L. Montgomery, et al. (2011). "Successful establishment of Wolbachia in Aedes populations to suppress dengue transmission." Nature 476(7361): 454-457.
Hughes, G. L., R. Koga, et al. (2011). "Wolbachia infections are virulent and inhibit the human malaria parasite Plasmodium falciparum in anopheles gambiae." PLoS pathogens 7(5): e1002043.
McMeniman, C. J., R. V. Lane, et al. (2009). "Stable introduction of a life-shortening Wolbachia infection into the mosquito Aedes aegypti." Science 323(5910): 141-144.
McMeniman, C. J. and S. L. O'Neill (2010). "A virulent Wolbachia infection decreases the viability of the dengue vector Aedes aegypti during periods of embryonic quiescence." PLoS neglected tropical diseases 4(7): e748.
Min KT, Benzer S (1997) Wolbachia, normally a symbiont of Drosophila, can be virulent, causing degeneration and early death. Proc Natl Acad Sci USA 94: 10792?10796.
Moreira, L. A., I. Iturbe-Ormaetxe, et al. (2009). "A Wolbachia symbiont in Aedes aegypti limits infection with dengue, Chikungunya, and Plasmodium." Cell 139(7): 1268-1278.
Riegler, M., Sidhu, M., Miller, W. J. & O’Neill, S. L. Evidence for a global Wolbachia replacement in Drosophila melanogaster. Curr. Biol. 15, 1428?1433 (2005).
Sinkins, S. P. and F. Gould (2006). "Gene drive systems for insect disease vectors." Nat Rev Genet 7(6): 427-435.
Walker, T., P. H. Johnson, et al. (2011). "The wMel Wolbachia strain blocks dengue and invades caged Aedes aegypti populations." Nature 476(7361): 450-453.
Hosokawa, T., R. Koga, et al. (2010). "Wolbachia as a bacteriocyte-associated nutritional mutualist." Proc Natl Acad Sci U S A 107(2): 769-774.
Hoffmann, A. A., B. L. Montgomery, et al. (2011). "Successful establishment of Wolbachia in Aedes populations to suppress dengue transmission." Nature 476(7361): 454-457.
Hughes, G. L., R. Koga, et al. (2011). "Wolbachia infections are virulent and inhibit the human malaria parasite Plasmodium falciparum in anopheles gambiae." PLoS pathogens 7(5): e1002043.
McMeniman, C. J., R. V. Lane, et al. (2009). "Stable introduction of a life-shortening Wolbachia infection into the mosquito Aedes aegypti." Science 323(5910): 141-144.
McMeniman, C. J. and S. L. O'Neill (2010). "A virulent Wolbachia infection decreases the viability of the dengue vector Aedes aegypti during periods of embryonic quiescence." PLoS neglected tropical diseases 4(7): e748.
Min KT, Benzer S (1997) Wolbachia, normally a symbiont of Drosophila, can be virulent, causing degeneration and early death. Proc Natl Acad Sci USA 94: 10792?10796.
Moreira, L. A., I. Iturbe-Ormaetxe, et al. (2009). "A Wolbachia symbiont in Aedes aegypti limits infection with dengue, Chikungunya, and Plasmodium." Cell 139(7): 1268-1278.
Riegler, M., Sidhu, M., Miller, W. J. & O’Neill, S. L. Evidence for a global Wolbachia replacement in Drosophila melanogaster. Curr. Biol. 15, 1428?1433 (2005).
Sinkins, S. P. and F. Gould (2006). "Gene drive systems for insect disease vectors." Nat Rev Genet 7(6): 427-435.
Walker, T., P. H. Johnson, et al. (2011). "The wMel Wolbachia strain blocks dengue and invades caged Aedes aegypti populations." Nature 476(7361): 450-453.