ワクチンに係る規制・制度の現状 (平成24年3月2日) 厚生労働省
PMDAの業務と最近の取組み(平成25年5月30日) PMDA
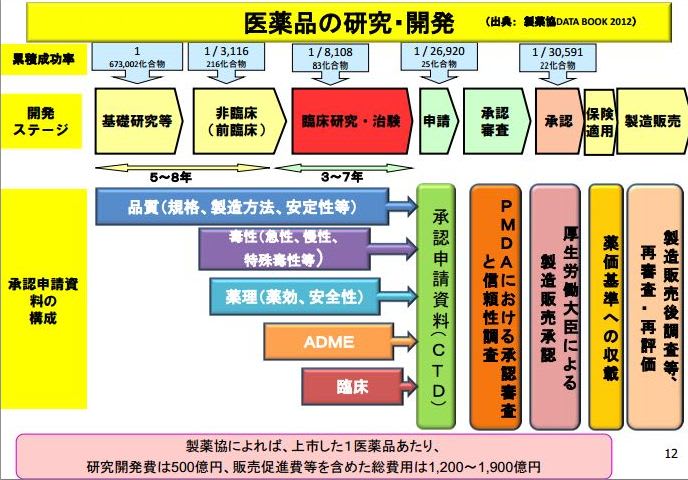
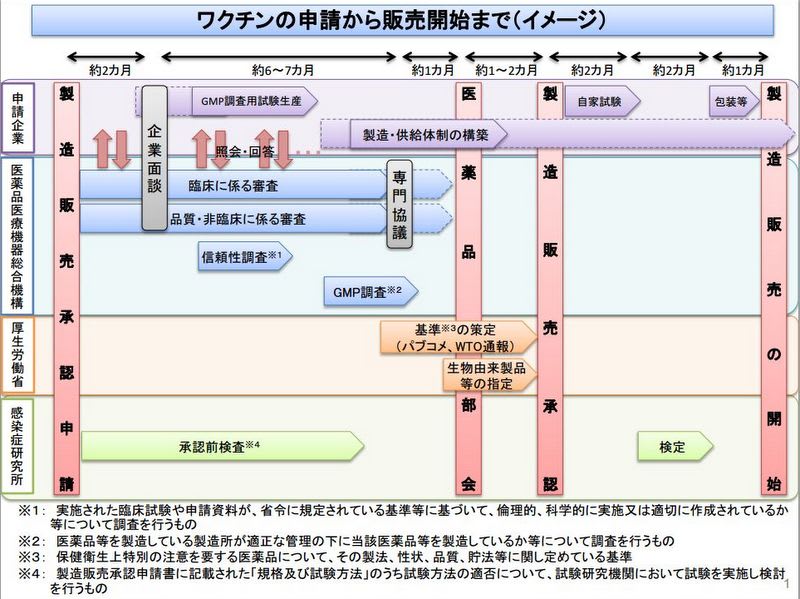
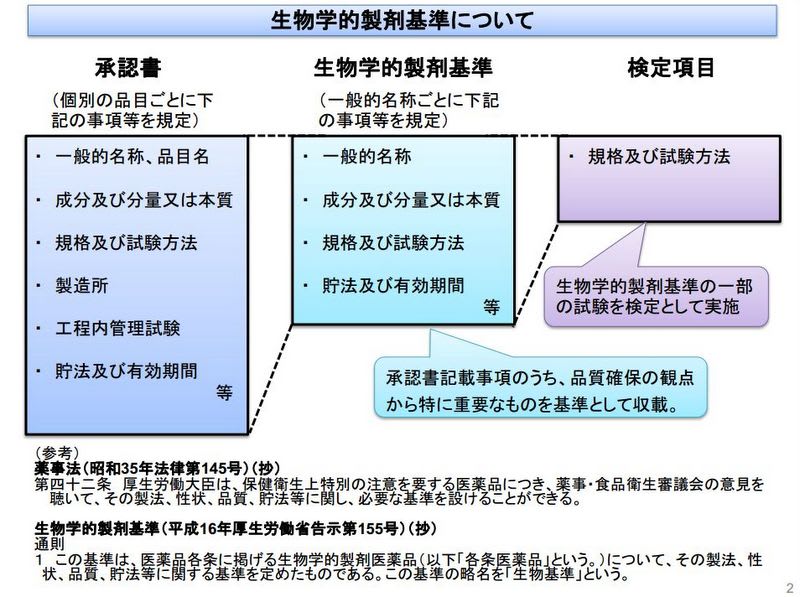


販売承認後の国家検定については、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律の第43条に規定される
(検定)
第43条 厚生労働大臣の指定する医薬品又は再生医療等製品は、厚生労働大臣の指定する者の検定を受け、かつ、これに合格したものでなければ、販売し、授与し、又は販売若しくは授与の目的で貯蔵し、若しくは陳列してはならない。ただし、厚生労働省令で別段の定めをしたときは、この限りでない。
2 厚生労働大臣の指定する医療機器は、厚生労働大臣の指定する者の検定を受け、かつ、これに合格したものでなければ、販売し、貸与し、授与し、若しくは販売、貸与若しくは授与の目的で貯蔵し、若しくは陳列し、又は医療機器プログラムにあつては、電気通信回線を通じて提供してはならない。ただし、厚生労働省令で別段の定めをしたときは、この限りでない。
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第四十三条第一項の規定に基づき検定を要するものとして厚生労働大臣の指定する医薬品等は、検定を受けるべき医薬品、手数料及び試験品の数量として告示(厚生省告示第二百七十九号)されている。
ワクチンに関する副反応の報告について
定期接種について
予防接種法
(定期の予防接種等を受けたことによるものと疑われる症状の報告)
第十二条 病院若しくは診療所の開設者又は医師は、定期の予防接種等を受けた者が、当該定期の予防接種等を受けたことによるものと疑われる症状として厚生労働省令で定めるものを呈していることを知ったときは、その旨を厚生労働省令で定めるところにより厚生労働大臣に報告しなければならない。
2 厚生労働大臣は、前項の規定による報告があったときは、遅滞なく、厚生労働省令で定めるところにより、その内容を当該定期の予防接種等を行った市町村長又は都道府県知事に通知するものとする。
予防接種法施行規則
(報告すべき症状)
第五条 法第十二条第一項 に規定する厚生労働省令で定めるものは、次の表の上欄に掲げる対象疾病の区分ごとにそれぞれ同表の中欄に掲げる症状であって、それぞれ接種から同表の下欄に掲げる期間内に確認されたものとする。
関連通知:定期の予防接種等による副反応の報告等の取扱いについて
任意接種について
(副作用等の報告)
第六十八条の十 医薬品、医薬部外品、化粧品、医療機器若しくは再生医療等製品の製造販売業者又は外国特例承認取得者は、その製造販売をし、又は第十九条の二、第二十三条の二の十七若しくは第二十三条の三十七の承認を受けた医薬品、医薬部外品、化粧品、医療機器又は再生医療等製品について、当該品目の副作用その他の事由によるものと疑われる疾病、障害又は死亡の発生、当該品目の使用によるものと疑われる感染症の発生その他の医薬品、医薬部外品、化粧品、医療機器又は再生医療等製品の有効性及び安全性に関する事項で厚生労働省令で定めるものを知つたときは、その旨を厚生労働省令で定めるところにより厚生労働大臣に報告しなければならない。
2 薬局開設者、病院、診療所若しくは飼育動物診療施設の開設者又は医師、歯科医師、薬剤師、登録販売者、獣医師その他の医薬関係者は、医薬品、医療機器又は再生医療等製品について、当該品目の副作用その他の事由によるものと疑われる疾病、障害若しくは死亡の発生又は当該品目の使用によるものと疑われる感染症の発生に関する事項を知つた場合において、保健衛生上の危害の発生又は拡大を防止するため必要があると認めるときは、その旨を厚生労働大臣に報告しなければならない。
関連通知:定期の予防接種等による副反応の報告等の取扱いについて
任意接種における報告対象となる情報は、予防接種ワクチンの使用による副作用、感染症の発生について、保健衛生上の危害の発生又は拡大を防止する観点から報告の必要があると判断した情報(症例)であり、具体的には以下の事項(症例)を参考とすること。なお、ワクチンとの因果関係が必ずしも明確でない場合であっても報告の対象となり得ること。
(1) 死亡
(2) 障害
(3) 死亡につながるおそれのある症例
(4) 障害につながるおそれのある症例
(5) 治療のために病院又は診療所への入院又は入院期間の延長が必要とされる症状((3)及び(4)に掲げる症例を除く。)
(6) (1)から(5)までに掲げる症例に準じて重篤である症例
(7) 後世代における先天性の疾病又は異常
(8) 当該医薬品の使用によるものと疑われる感染症による症例等の発生
(9) (1)から(8)までに示す症例以外で、軽微ではなく、かつ、添付文書等から予測できない未知の症例等の発生