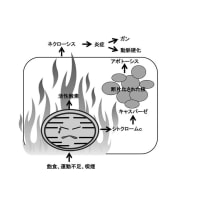
健康科学の分野では「食が寿命を縮める」ことは常識になりつつあります。「私たちは食べなくては生きていけない、食べすぎても生きていけない」、「To eat or not to eat, that is the question(食べるべきか、食べざるべきか、それが問題だ)」というハムレットのような悩みを背負わされているのです。その原因は、「インスリン・シグナル(情報伝達)」にあります。インスリンというホルモンは、生きる原動力を生みだすエネルギー産生工場の扉を開きますが、一方では老化を促すマスタースイッチをオンにするのです。それではここで、私たちの生活になくてはならない「食」が老化を引き起こすシグナルについてご説明します。イラストを参照してください。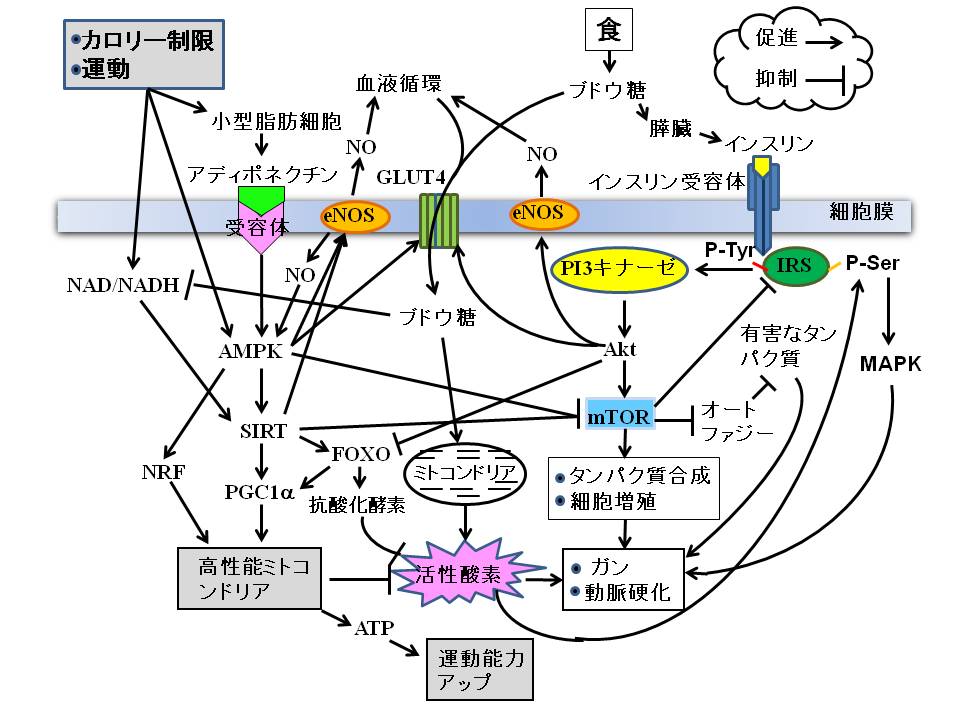
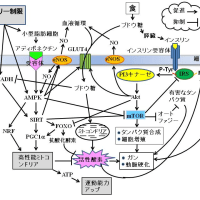
食によって体内に入ったブドウ糖は膵臓でインスリン分泌を促します。血中に放出されたインスリンは、細胞表面のインスリン受容体に結合します。インスリンなどのホルモンと受容体との関係は鍵と鍵穴との関係に似ています。鍵が鍵穴にぴったりと填って初めて情報伝達経路のスイッチがオンとなります。インスリンがインスリン受容体に結合すると、インスリン受容体基質[Insulin Receptor Substrate (IRS)] にあるチロシンというアミノ酸のリン酸化(P-Tyr)が起こります。チロシンがリン酸化されたIRSは、Phosphatidylinositol 3-kinase (PI3K)/Aktを活性化し、細胞質に存在するブドウ糖輸送体 [Glucose Transporter 4 (GLUT4)] を細胞膜へ移行させ、ブドウ糖の取り込みを促します。インスリンからインスリン受容体/IRS/PI3K/Akt/GLUT4への道順は、インスリンがブドウ糖を代謝するシグナル伝達系の本道です。成長期には主としてこの経路が活性化され、少々食べ過ぎても糖尿病にはなりません。しかし、年齢を重ねると「そうは問屋がおろさない」のです。
インスリンによって活性化されるAktはその下流でmTOR (Mammalian Target of Rapamycin) を活性化します。mTORはタンパク質の合成を促し、若年者では成長を保証し免疫力をアップしますが、高齢者ではガンや動脈硬化を促します。mTORはオートファジー(自食作用)を抑制します。オートファジーは飢餓状態で誘導され、自己の細胞質成分を分解し、その分解産物を栄養素として確保することが主な作用ですが、細胞内に蓄積したさまざまな有害な物質を分解するシステムでもあります。また、mTORの持続的な活性化はインスリン・シグナルに対する負の制御としてIRSを分解します。その結果、インスリン受容体刺激はPI3K/Akt/GLUT4に伝わらなくなり、インスリン抵抗性を引き起こします。インスリン抵抗性とは、インスリンは十分分泌されているのにブドウ糖代謝に向かうインスリン・シグナルが活性化されない現象です。これは糖尿病を発症させる重要なメカニズムの一つです。
一方、インスリンの作用で細胞内に取り込まれ代謝されたブドウ糖は、ミトコンドリアの電子伝達系でATPを産みだします。ATPは細胞内のエネルギー通貨として活動力の源になります。しかし、過食や運動不足で過剰に供給されたブドウ糖由来の電子は、電子伝達系に鬱滞し、漏れ出た電子が活性酸素を生みだしてガンや動脈硬化を引き起こします。活性酸素はIRSのチロシンではなく、セリンというアミノ酸のリン酸化を促します。このセリンリン酸化(P-Ser)が、インスリン・シグナルをブドウ糖代謝経路から、分裂促進因子活性化タンパク質 キナーゼ [Mitogen-Activated Protein Kinase (MAPK)] を介した細胞増殖経路に切り替えます。これは、インスリン抵抗性のもう一つの原因になるとともに、動脈硬化やガンを引き起こす可能性があります。
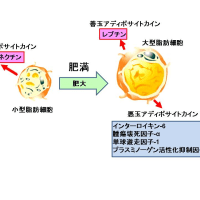
逆に、カロリー制限や運動は私たちの健康にどのようなポジティブな効果をもたらすのでしょうか?カロリー制限や運動は肥満した内臓脂肪細胞を小型脂肪細胞に変えます。小型脂肪細胞からはアディポネクチンという若返りホルモンが分泌されます。アディポネクチンがアディポネクチン受容体に結合すると、AMP-activated protein kinase (AMPK)が活性化されます。AMPKは細胞内のエネルギーセンサーとして、細胞を飢餓から守るために必要な種々のタンパク質をリン酸化しています。AMPKは栄養不足や低酸素状態、虚血、あるいは熱ショックなど、細胞内でATP供給を枯渇させるようなストレスに応答して活性化され、ATP供給を補充させるシグナル経路を正に調節します。AMPKが活性化されるとGLUT4を介するブドウ糖の細胞外からの取り込みや細胞内での代謝が進み、血糖が低下します。また、AMPKはeNOSを活性化してNOの産生を高めます。NOは血管を拡張して筋肉や臓器の血液循環を増加させ、細胞へのブドウ糖の供給を増やします。このメカニズムもAMPKの活性化が血糖を下げることに貢献しています。
AMPKはカロリー制限や運動に伴ってアディポネクチン非依存性にも活性化され、さまざまな長寿遺伝子の上流に位置する老化制御のマスタースイッチとして働いています。AMPKには長寿遺伝子の一つであるサーチュイン(休止情報の調節因子[Silent Mating Type Information Regulation (SIRT)])や核呼吸因子 [Nuclear Respiratory Factor(NRF)]を活性化する働きがあります。サーチュインは細胞内でエネルギーが枯渇し、NAD/NADH比が上昇すると活性化されます。活性化されたサーチュインは次にPGC1α (Peroxisome Proliferator-activated Receptor-γ Coactivator)の活性を高めます。PGC1αはミトコンドリアの再生にとって不可欠なタンパク質です。PGC1αはNRFとともにミトコンドリアの質と量を向上させます。そうすると、ミトコンドリアにおけるATP合成効率は上昇し、逆に活性酸素の産生は低下するのです。
AMPKはSIRTの次にFOXO (Forkhead Transcriptional Factor)と呼ばれる転写因子の働きを活発にします。転写因子とは核内での遺伝子発現を制御するタンパク質です。FOXOはインスリンの作用が活発でPI3キナーゼ/Aktが活性化されている状態では抑制されていますが、PI3キナーゼ/Aktが不活性化され、AMPK/SIRTが活性化された状態ではスイッチがオンとなります。FOXOには抗酸化酵素の遺伝子発現を増やす働きがあります。したがって、AMPKが活性化されていれば、ブドウ糖が細胞内に多く取り込まれてもミトコンドリアで活性酸素の産生が増えることはなく、活性酸素は速やかに除去されることになるのです。ミトコンドリアで作られる活性酸素は老化の進行に重要に関わっています。食べ過ぎず、適度な運動をする生活、それこそがミトコンドリアに活性酸素を作らせない長生きの秘訣なのです。
このブログは風詠社出版の『長生きしたければミトコンドリアの声を聞け』の一部を抜粋、編集したものです。小著では少子高齢化社会を生き抜く真のサクセスフル・エイジングとは何かをテーマに、健康長寿を目指す「人」と「社会」に向けてミトコンドリアの立場と視点からメッセージを送っています。

食によって体内に入ったブドウ糖は膵臓でインスリン分泌を促します。血中に放出されたインスリンは、細胞表面のインスリン受容体に結合します。インスリンなどのホルモンと受容体との関係は鍵と鍵穴との関係に似ています。鍵が鍵穴にぴったりと填って初めて情報伝達経路のスイッチがオンとなります。インスリンがインスリン受容体に結合すると、インスリン受容体基質[Insulin Receptor Substrate (IRS)] にあるチロシンというアミノ酸のリン酸化(P-Tyr)が起こります。チロシンがリン酸化されたIRSは、Phosphatidylinositol 3-kinase (PI3K)/Aktを活性化し、細胞質に存在するブドウ糖輸送体 [Glucose Transporter 4 (GLUT4)] を細胞膜へ移行させ、ブドウ糖の取り込みを促します。インスリンからインスリン受容体/IRS/PI3K/Akt/GLUT4への道順は、インスリンがブドウ糖を代謝するシグナル伝達系の本道です。成長期には主としてこの経路が活性化され、少々食べ過ぎても糖尿病にはなりません。しかし、年齢を重ねると「そうは問屋がおろさない」のです。
インスリンによって活性化されるAktはその下流でmTOR (Mammalian Target of Rapamycin) を活性化します。mTORはタンパク質の合成を促し、若年者では成長を保証し免疫力をアップしますが、高齢者ではガンや動脈硬化を促します。mTORはオートファジー(自食作用)を抑制します。オートファジーは飢餓状態で誘導され、自己の細胞質成分を分解し、その分解産物を栄養素として確保することが主な作用ですが、細胞内に蓄積したさまざまな有害な物質を分解するシステムでもあります。また、mTORの持続的な活性化はインスリン・シグナルに対する負の制御としてIRSを分解します。その結果、インスリン受容体刺激はPI3K/Akt/GLUT4に伝わらなくなり、インスリン抵抗性を引き起こします。インスリン抵抗性とは、インスリンは十分分泌されているのにブドウ糖代謝に向かうインスリン・シグナルが活性化されない現象です。これは糖尿病を発症させる重要なメカニズムの一つです。
一方、インスリンの作用で細胞内に取り込まれ代謝されたブドウ糖は、ミトコンドリアの電子伝達系でATPを産みだします。ATPは細胞内のエネルギー通貨として活動力の源になります。しかし、過食や運動不足で過剰に供給されたブドウ糖由来の電子は、電子伝達系に鬱滞し、漏れ出た電子が活性酸素を生みだしてガンや動脈硬化を引き起こします。活性酸素はIRSのチロシンではなく、セリンというアミノ酸のリン酸化を促します。このセリンリン酸化(P-Ser)が、インスリン・シグナルをブドウ糖代謝経路から、分裂促進因子活性化タンパク質 キナーゼ [Mitogen-Activated Protein Kinase (MAPK)] を介した細胞増殖経路に切り替えます。これは、インスリン抵抗性のもう一つの原因になるとともに、動脈硬化やガンを引き起こす可能性があります。
逆に、カロリー制限や運動は私たちの健康にどのようなポジティブな効果をもたらすのでしょうか?カロリー制限や運動は肥満した内臓脂肪細胞を小型脂肪細胞に変えます。小型脂肪細胞からはアディポネクチンという若返りホルモンが分泌されます。アディポネクチンがアディポネクチン受容体に結合すると、AMP-activated protein kinase (AMPK)が活性化されます。AMPKは細胞内のエネルギーセンサーとして、細胞を飢餓から守るために必要な種々のタンパク質をリン酸化しています。AMPKは栄養不足や低酸素状態、虚血、あるいは熱ショックなど、細胞内でATP供給を枯渇させるようなストレスに応答して活性化され、ATP供給を補充させるシグナル経路を正に調節します。AMPKが活性化されるとGLUT4を介するブドウ糖の細胞外からの取り込みや細胞内での代謝が進み、血糖が低下します。また、AMPKはeNOSを活性化してNOの産生を高めます。NOは血管を拡張して筋肉や臓器の血液循環を増加させ、細胞へのブドウ糖の供給を増やします。このメカニズムもAMPKの活性化が血糖を下げることに貢献しています。
AMPKはカロリー制限や運動に伴ってアディポネクチン非依存性にも活性化され、さまざまな長寿遺伝子の上流に位置する老化制御のマスタースイッチとして働いています。AMPKには長寿遺伝子の一つであるサーチュイン(休止情報の調節因子[Silent Mating Type Information Regulation (SIRT)])や核呼吸因子 [Nuclear Respiratory Factor(NRF)]を活性化する働きがあります。サーチュインは細胞内でエネルギーが枯渇し、NAD/NADH比が上昇すると活性化されます。活性化されたサーチュインは次にPGC1α (Peroxisome Proliferator-activated Receptor-γ Coactivator)の活性を高めます。PGC1αはミトコンドリアの再生にとって不可欠なタンパク質です。PGC1αはNRFとともにミトコンドリアの質と量を向上させます。そうすると、ミトコンドリアにおけるATP合成効率は上昇し、逆に活性酸素の産生は低下するのです。
AMPKはSIRTの次にFOXO (Forkhead Transcriptional Factor)と呼ばれる転写因子の働きを活発にします。転写因子とは核内での遺伝子発現を制御するタンパク質です。FOXOはインスリンの作用が活発でPI3キナーゼ/Aktが活性化されている状態では抑制されていますが、PI3キナーゼ/Aktが不活性化され、AMPK/SIRTが活性化された状態ではスイッチがオンとなります。FOXOには抗酸化酵素の遺伝子発現を増やす働きがあります。したがって、AMPKが活性化されていれば、ブドウ糖が細胞内に多く取り込まれてもミトコンドリアで活性酸素の産生が増えることはなく、活性酸素は速やかに除去されることになるのです。ミトコンドリアで作られる活性酸素は老化の進行に重要に関わっています。食べ過ぎず、適度な運動をする生活、それこそがミトコンドリアに活性酸素を作らせない長生きの秘訣なのです。
このブログは風詠社出版の『長生きしたければミトコンドリアの声を聞け』の一部を抜粋、編集したものです。小著では少子高齢化社会を生き抜く真のサクセスフル・エイジングとは何かをテーマに、健康長寿を目指す「人」と「社会」に向けてミトコンドリアの立場と視点からメッセージを送っています。