Peptidyl-carrier Proteins
SBKB [doi:10.3942/psi_sgkb/fm_2014_10]
図1 PDBID: 4NEOの構造。
細菌は、常に自然資源を活用し、競合他者との戦いは珍しい分子を構築するための新しい方法を発見する、創造的な化学者である。これらの分子の多くは、短いタンパク質のように見えるが、それらは従来のタンパク質と同じように構築されていない。DNA内の情報を使用する代わりに、各分子が終了するまで、それぞれが一度に一つのピースを加えること、酵素の専用の組立ラインを使用して構築する。 おなじみの抗生物質は、バンコマイシンおよびブレオマイシンのように、この方法で作られている。この方法の利点の一つは、外来の分子のあらゆる種類の代わりに20の天然アミノ酸に限定されできるということである。例えば、反対のキラリティーをもつアミノ酸を使用することができる、または完全に異なる側鎖を有するアミノ酸をも含む。この多様性は、他の細胞の自然な防御に非常に特化した機能や耐性を有する分子を作成するために細菌を可能にする。不利な点は、当然のことながら、細胞は多くの合成のステップを実行するために専用の酵素の数十を構築し、プロセスに多くのリソースを投資しなければならないことである。
これらの分子組立ラインは、タンパク質の三種類で構成されている。一つは、典型的には、ATPに結合することによって、ビルディングブロックを見つけ、それを活性化する酵素である。もう一つの酵素は、成長するペプチドにビルディングブロックを取り付け、合成反応を実行する。各モジュールにおける第3のタンパク質は、プロセス中にペプチドを保持するキャリアタンパク質である。最近、MCSGとNatPro(PDBID:4neo)でのPSIの研究者の共同研究で決定し、ここで示したキャリアタンパク質は、ブレオマイシン、断片にDNAを破壊する強力な抗生物質の合成に関与している。この小さなキャリアタンパク質は、それが構築されているように(特別な補欠分子族を介して結合している)ブレオマイシンを保持するためのハンドルとして機能し、末端セリンのアミノ酸を持っている。
細菌は、これらのモジュール式組立ラインを構築するには、2つの異なるアプローチを取る。 I型のシステムでは、酵素および担体の多くは、一つの長いタンパク質鎖に接続され、成長している分子は、モジュールからモジュール渡される。ここで(PDBエントリー2vsq)に示す構造は、サーファクチンAの構築のための最終的なモジュールは、構造が終了キャリア活性化酵素、合成酵素、および1つ以上の酵素を含む示す工程である。タイプIIのシステムは、独立した酵素が、すべての建設のプロセスの間に一緒に働く担体と、生合成をより身近なアプローチを取る。上に示したBlmI構造は、タイプIIペプチド担体の第1の構成である。
これらのキャリアタンパク質へのトリックは、容易に次の合成工程中の酵素に転送することができるように、活性化され、アクセス可能な状態で成長しているペプチドを保持することである。これを行うために、彼らはロング補欠分子族を使用する。これはキャリア上のセリンに接続され、末尾の硫黄原子を有する長い柔軟な鎖を有している。ビルディングブロックは、転送を容易にし、不安定な結合を介してそこに取り付けられている。 (その他、PDBID:2lki、2ll8と2lml)。











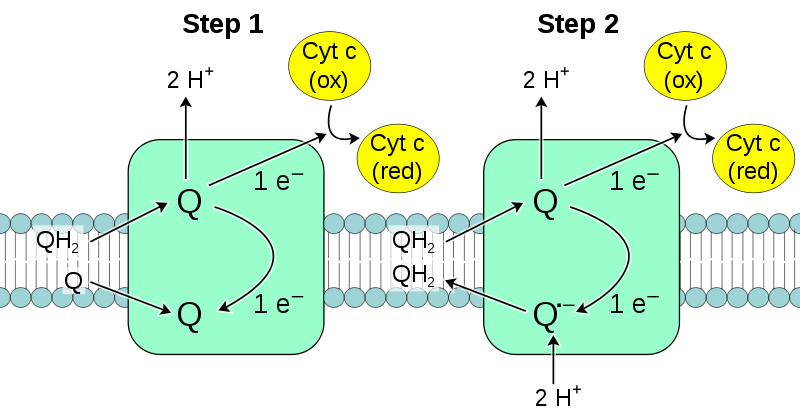
 。図1 複合体Ⅲの結晶構造(PDNID: 1BCC)をCHEM3Dで描画。蛋白部分は(cartoon白色)に統一し、Ligandは通常の元素色を用いた、形はSpace Fillingで描いた。中央部にUQの一部が見える。
。図1 複合体Ⅲの結晶構造(PDNID: 1BCC)をCHEM3Dで描画。蛋白部分は(cartoon白色)に統一し、Ligandは通常の元素色を用いた、形はSpace Fillingで描いた。中央部にUQの一部が見える。