図:肥満細胞(マスト細胞)は中身の詰まった顆粒を多数有しており、この顆粒の中にはヒスタミンなどの炎症性メディエーターが含まれている。肥満細胞はIgEに対する高親和性受容体を発現しており、抗原が結合したIgEを介して受容体が架橋することにより、肥満細胞が活性化され、「脱顆粒」と呼ばれるプロセスを経て、顆粒内部のヒスタミンをはじめとする炎症性メディエーターが遊離する。その結果、炎症や免疫応答などに関与する。
肥満細胞がヒスタミン分泌を介して骨髄由来抑制細胞の活性を高めることが報告されています。次のような論文があります。
Mast cell histamine promotes the immunoregulatory activity of myeloid-derived suppressor cells. (肥満細胞のヒスタミンは骨髄由来抑制細胞の免疫制御活性を促進する)Journal of Leukocyte Biology. 96(1):151-159. 2014年
【要旨】
骨髄由来抑制細胞(MDSC)の免疫応答の制御において、肥満細胞が重要な役割を担っている。
顆粒球性MDSCは寄生虫の除去に必要で、単球性MDSCは腫瘍の進行を促進する。そして、これらの活性は肥満細胞を欠如するマウスでは消失することが報告されている。
この研究では、肥満細胞の欠如はMDSC(骨髄由来抑制細胞)の移動や動員にも影響することを明らかにした。
肥満細胞を欠如したマウスでは、MDSCの肝臓への移動はみられなかった。さらに、MDSCの移動と活性化には肥満細胞から分泌されるメディエーターのヒスタミンが重要な役割を担っていた。
MDSCはヒスタミン受容体1~3(HR1–3)を発現しており、これらの受容体をHR1あるいはHR2受容体のアンタゴニスト(阻害剤)で阻害すると、MDSCの生存や増殖を促進するヒスタミンの作用は認められなくなった。
さらに、ヒスタミンはMDSCの遺伝子発現にも影響した。これらの培養細胞でのヒスタミンの作用は生体内でも認められた。すなわち、ヒスタミン受容体の阻害剤を投与すると、MDSCによる寄生虫排除とがん細胞転移に対する作用が阻止された。
MDSCはTh2免疫を促進してアレルギーを引き起こしやすくする作用がある。実際にアレルギー疾患の患者はMDSCの数が増えている。
以上の結果より、肥満細胞と肥満細胞から分泌されるヒスタミンはMDSC(骨髄由来抑制細胞)による免疫制御に重要な働きを担っており、MDSCをターゲットにした治療法の開発においては、この肥満細胞とMDSCの相互作用を考慮する必要があることが示された。
Mast cells boost myeloid-derived suppressor cell activity and contribute to the development of tumor-favoring microenvironment.(肥満細胞は骨髄由来抑制細胞の活性を高めて、がん細胞に都合の良い微小環境の形成に関与している)Cancer Immunol Res. 3(1):85-95. 2015年
【要旨】
炎症はがん組織の発生と成長を促進し、がん細胞に対する免疫監視機構の働きや免疫治療の効果を阻害する。
骨髄由来抑制細胞は免疫抑制性のネットワークの主要な細胞の一つであり、がん細胞の増殖を促進する作用がある。がん細胞に対する免疫応答において、骨髄由来抑制細胞と肥満細胞の相互作用が重要であることが明らかになっている。
この研究では、大腸がん患者の粘膜組織と担がんマウスの大腸と脾臓における、骨髄由来抑制細胞と肥満細胞との相互作用について検討した。
さらに、CT-26大腸がん細胞はCD11b(+)Gr1(+)の未成熟の骨髄由来抑制細胞を誘導し、がん細胞に加担する肥満細胞を腫瘍組織に動員することを示した。
肥満細胞は、インターフェロン-γと一酸化窒素の産生が関連するメカニズムで、脾臓由来の単球性骨髄由来抑制細胞の免疫抑制活性を亢進した。
さらに、CD40とCD40リガンドを介した肥満細胞と骨髄由来抑制細胞の相互作用が、がん組織における炎症状態を亢進し、骨髄由来抑制細胞の動員とがん細胞の増殖を促進するメディエーターの産生を高めることに関与していることを示した。
以上の結果より、骨髄由来抑制細胞と肥満細胞の相互作用を阻止する方法は、骨髄由来抑制細胞による免疫抑制を阻止し、抗腫瘍免疫を活性化するうえで有効であることが示唆された。
多くのがん患者において、末梢血中のMDSC(骨髄由来抑制細胞)が増えており、MDSCの数が多いほど予後が悪いという報告があります。
肥満細胞からのヒスタミンがMDSCの移動や増殖を促進し、遺伝子発現に影響することが明らかになってきました。
炎症とがんの関連については、多くのメカニズムがありますが、肥満細胞と骨髄由来抑制細胞の相互作用も重要だということです。
肥満細胞の働きを阻害してヒスタミンの分泌を抑制したり、ヒスタミン受容体の阻害剤が骨髄由来抑制細胞の働きを抑制して、抗腫瘍免疫を高める作用があるようです。
つまり、骨髄由来抑制細胞の働きを阻止して、抗腫瘍免疫を高めるとき、肥満細胞の活性抑制やヒスタミン受容体阻害剤の利用は有効だと考えられています。
【シメチジンはMDSCを阻害する】
肥満細胞とそれから産生されるヒスタミンが骨髄由来抑制細胞(MDSC)を活性化することが、がん組織において抗腫瘍免疫が十分に作動しない理由の一つになっています。
したがって、肥満細胞の働きを抑制したり、ヒスタミンの作用を阻害する治療法は、がん細胞に対する免疫的攻撃を増強できると言えます。
肥満細胞の働きを抑制する方法として、パルミトイルエタノールアミドがあります。
パルミトイルエタノールアミド(Palmitoylethanolaide; PEA)は炭素数16の脂肪酸のパルミチン酸にエタノールアミンが結合した体内成分で、古くから鎮痛作用や抗炎症作用が知られており、その作用機序として肥満細胞の脱顆粒を抑制して、抗炎症作用を示すことが報告されています。(
440話参照)
ヒスタミン受容体拮抗薬のシメチジンには様々な抗腫瘍効果が報告されていますが、抗腫瘍免疫を高める作用があり、そのメカニズムの一つとして骨髄由来抑制細胞の抑制作用が報告されています。以下のような報告があります。
Cimetidine suppresses lung tumor growth in mice through proapoptosis of myeloid-derived suppressor cells.(シメチジンは骨髄由来抑制細胞のアポトーシスを誘導することによってマウスにおける肺がん細胞の増殖を抑制する)Mol Immunol. 54(1):74-83.2013年
【要旨】
ヒスタミンH2受容体の阻害剤(アンタゴニスト)のシメチジンはヒトや動物の腫瘍細胞の増殖を阻害することが報告されているが、その作用メカニズムについては十分に解明されていない。
本研究では、3LL肺がん細胞をマウスに移植する実験系で、シメチジンが腫瘍細胞の増殖を顕著に抑制することを示した。しかし、培養細胞を用いたin vitroの実験系では、シメチジンは3LL細胞の増殖や生存や移動や浸潤に対して抑制作用は示さなかった。
シメチジンは担がんマウスにおける脾臓や末梢血中や腫瘍組織におけるCD11b(+)Gr-1(+)の骨髄由来抑制細胞の集積を減少させた。
In vitroの培養細胞の実験系で、シメチジンはMDSCによるT細胞の抑制作用を阻止し、IFN-γ産生を増強した。
シメチジンはMDSCの一酸化窒素産生とアルギナーゼI発現を抑制し、MDSCのアポトーシスを誘導した。しかしながら、MDSCの細胞分化には影響しなかった。
重要なことは、MDSCの細胞表面にヒスタミンH2受容体が発現していたが、ヒスタミンはシメチジンのアポトーシス誘導作用を阻止できなかった。さらに、ファモチジン(famotidine)にはシメチジンのようなアポトーシス誘導作用は認めなかった。
シメチジンはMDSC細胞表面にFasとFasLの発現を誘導し、カスパーゼ依存性のアポトーシスを誘導することが明らかになった。
以上の結果から、シメチジンがMDSCのアポトーシスを誘導することによって腫瘍の増殖を阻止する新しいメカニズムが明らかになった。
つまり、シメチジンはがん細胞の増殖を直接抑制する作用は無いが、骨髄由来抑制細胞のアポトーシスを誘導して抗腫瘍免疫を高める作用メカニズムによって、がん細胞の増殖を抑える効果があるという内容です。
【シメチジンの抗腫瘍効果】
生体内アミンであるヒスタミンは、炎症反応や胃酸分泌、アレルギー反応など様々な生理反応に関与しています。
ヒスタミンは細胞表面にある受容体に結合することによって細胞にヒスタミンの刺激を伝えます。
ヒスタミンの受容体は現在までに 3 種類のサブタイプ(H1~H3)が見つかっていますが、そのうち H2 受容体は胃酸分泌において中心的な役割を担っており、その拮抗薬であるシメチジンは胃酸の分泌を抑える効果により胃炎や消化性潰瘍や逆流性食堂炎などの治療薬として使用されています。
1980 年代後半に デンマークのTonnesen らにより、シメチジンが胃がん患者に対し延命効果を示すことが報告され、その後、大腸がん、悪性黒色腫に対しても同様の効果を示すことが報告されています。
例えば、治癒切除術後5-FU(200mg/日)投与を受けている原発性大腸がん患者(シメチジン800mg/日併用群34例、非併用群30例の計64例)において、平均10.7年の観察期間での10年生存率は、シメチジン併用群で84.6%、シメチジン非併用群で49.8%でした(P<00001)。
切除手術を受けた大腸がん患者を対象にした臨床試験のメタ解析によると、シメチジンを服用することによって死亡リスクが0.53に低下すると報告されています。
ヒスタミンにはがん細胞の増殖を促進する作用や、細胞性免疫を抑制するリンパ球(骨髄由来抑制細胞や制御性T細胞)を活性化することなどが報告されており、そのためシメチジンの延命効果は、がん細胞に対するヒスタミンの細胞増殖促進作用を阻害する機序や、がん細胞に対する免疫力を活性化させ る可能性などが指摘されています。
さらに近年では、シメチジンが接着因子 E-セレクチンの発現を抑 制することによりがんの転移を抑制する抑える機序や、インターロイキン 12の発現上昇を介したナチュラルキラー細胞活性化、血管新生阻害作用によって腫瘍組織の増大を阻止する可能性、がん細胞にアポトーシス(細胞死)を誘導する作用など、新たなメカニズムも報告されています。
ラニチジンやファモチジンなど他のヒスタミン H2 受容体拮抗薬を用いた検討においては、それらがシメチ ジンと同等もしくはそれ以上に強力な薬理作用を有するにも関わらず、がん患者に対し同様の効果 が認められないという報告がなされています。
すなわちシメチジンの有する延命効果や腫瘍増殖抑 制作用などは、その H2 受容体拮抗作用だけによるものではなくシメチジン特有のものである可能性も指摘されています。
シメチジンは安価で安全性も高いので、がん治療に積極的に使用する根拠は高いと言えます。
【シメチジンの抗腫瘍免疫の増強作用】
シメチジンには様々なメカニズムで抗腫瘍免疫を増強することが報告されています。以下のような作用機序が報告されています。
○ 抗腫瘍免疫(Th1)の増強:
生体の免疫機構は細胞性免疫型(Th1)と体液性免疫型(Th2)のバランスにより制御されていますが、多くのがん患者や担がん状態の実験動物においてその免疫機構が Th2 型へ移行していることが報告されています。
がん細胞の排除には細胞性免疫(Th1細胞)が中心的な役割を担うと考えられていることから、Th2 型への移行は担がん宿主の免疫機能低下の一因であると考えられています。
免疫機構が Th2 型に移行している担がんマウスに IL-12 を投与すると腫瘍の顕著な退縮が認められることが数多く報告されています。 IL-12 はナチュラルキラー細胞や T 細胞をその傷害活性の誘導・増強に向けて活性化するのみでな く、生体の細胞性免疫を促進する根源的な役割を担うサイトカインです。
IL-12 の主な産生細胞 はマクロファージおよび B 細胞であることが知られていますが、近年マクロファージからの IL-12 産生をヒスタミンが抑制すること、またその抑制作用はヒスタミン H2 受容体拮抗薬を前処置した際には認められないことが報告されています。
多くのがん組織においてはヒスタミン含量の上昇や、ヒスタミン合成酵素であるヒスチジンデカルボキシラーゼ活性の上昇が確認されています。これらのことは、担がん状態における免疫機構の Th2 型への移行原因の一つに、上昇したヒスタミンに よるマクロファージからの IL-12 産生抑制が関与している可能性を示唆するものです。
したがって、ヒスタミンH2受容体拮抗薬は、IL-12の産生を高め、細胞性免疫(Th1細胞)の活性を高める効果が期待できます。
○ 樹状細胞の活性化:
がん細胞に対する免疫応答の中でがん抗原に対する免疫応答誘導において鍵となる細胞である樹状細胞の抗原提示能を増強させる可能性が報告されています。
○ ナチュラルキラー細胞の活性化:
インターロイキン12(IL-12)の発現を亢進してナチュラルキラー細胞活性を高める効果が報告されています。インターロイキン-12(IL-12)は、当初"NK細胞刺激因子"の名称で報告されたように、NK細胞に対する著明な活性化作用を特徴とするサイトカインです。
IL-12はB細胞および単球系細胞より産生され、T細胞やNK細胞に対して細胞増殖の促進、細胞傷害活性誘導、IFN-γ産生誘導、LAK細胞誘導などの作用を示します。こうした細胞性免疫機能への作用から、IL-12には感染防御やがん治療や免疫不全症の改善における臨床応用が期待されています。
前述のごとく、ヒスタミンはIL-12 の産生を抑制するので、シメチジンはIL-12の産生を高めてナチュラルキラー細胞活性を高める効果を発揮します。
○ 細胞傷害性Tリンパ球の活性化:
ヒスタミンには細胞傷害性Tリンパ球の生成を抑制する作用が知られています。さらにヒスタミンH2受容体はサプレッサーT細胞にも発現が認められ、ヒスタミンによりサプレッサーT細胞が活性化され、宿主側の免疫システムを減弱させると報告されています。そこでヒスタミンH2受容体拮抗薬が上記のヒスタミンの作用を抑制し、免疫システムを増強し、抗腫瘍作用を示すのではないかと推測されています。
また、抗腫瘍免疫の働きを弱める骨髄由来抑制細胞や制御性T細胞の働きをヒスタミンが高めるので、抗腫瘍免疫が抑制されるという報告もあります。
シメチジン投与群では腫瘍組織にリンパ球の浸潤が多く見られたという報告があります。このような腫瘍組織に浸潤するリンパ球の存在は、腫瘍に対する宿主の免疫応答を意味しており、予後が良いことを示すサインと言えます。つまり、シメチジンはがん組織に対する免疫応答(細胞性免疫)を増強する効果があると言えます。
大腸がんはヒスタミンを分泌し、がん組織の中のヒスタミンのレベルが高いことが報告されています。つまり、がん患者や手術後の病態における免疫抑制には、ヒスタミンが関与している可能性があり、H2ブロッカーによって、免疫力低下の機序を解除できる可能性が指摘されています。
しかし、ヒスタミンH2受容体を介してヒスタミンの免疫抑制作用を阻害するという作用機序はシメチジン以外のヒスタミンH2受容体拮抗薬が活性を持たないことから疑問視する意見もあります。
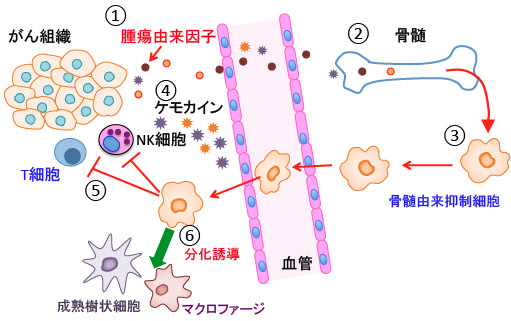
【レチノイドによるMSDCの分化誘導療法】
ATRA(All-trans retinoic acid)はビタミンA誘導体で核内受容体のレチノイン酸受容体やレチノイドX受容体に作用して遺伝子発現を誘導します。
ATRAが骨髄球の分化を誘導することはよく知られています。
ATRAがMDSCの分化を誘導して成熟させ、免疫抑制活性を低下させることが報告されています。
以下のような報告があります
All-trans-retinoic acid eliminates immature myeloid cells from tumor-bearing mice and improves the effect of vaccination.(オールトランス・レチノイン酸は担がんマウスの未熟な骨髄細胞を除去してワクチンの効果が高める)Cancer Res. 63(15):4441-9.2003年
【要旨】
がん組織による免疫抑制の誘導は、がん細胞が免疫監視機構を逃れる主要なメカニズムの一つである。がんワクチンの治療効果が得られにくいのは、がん組織誘導性の免疫抑制のメカニズムが作動しているためである。
がん組織による免疫抑制においては、未熟な骨髄細胞が重要な役割を果たしている。これらの未熟骨髄由来抑制細胞は担がんマウスにおいて増加し、様々なメカニズムでT細胞の機能を阻害する。
本研究では、抗腫瘍効果を高める目的で、骨髄由来抑制細胞を除去する実験を行った。
担がんマウスにオールトランス・レチノイン酸(all-trans-retinoic acid ;ATRA)を投与すると、全ての実験モデルにおいて腫瘍内の骨髄由来抑制細胞を減少することが示された。
この作用はATRAの直接的な殺細胞作用やがん細胞からの増殖因子の産生抑制とは関係なかった。
ATRAは未熟な骨髄由来抑制細胞を成熟樹状細胞やマクロファージや顆粒球に分化誘導した。
担がんマウスにおいて骨髄由来抑制細胞が除去されるとT細胞による腫瘍特異的な免疫応答が改善した。
2種類の異なるがんワクチンの実験モデルで、ATRAを併用すると、抗腫瘍免疫の効果が顕著に増強した。
以上の結果から、ATRAを使った未熟な骨髄由来抑制細胞を分化誘導によって除去する方法は、がんワクチンの治療効果を高める方法として役立つ可能性が示された。
Reversal of myeloid cell-mediated immunosuppression in patients with metastatic renal cell carcinoma.(転移性腎臓がん患者における骨髄由来細胞による免疫抑制の解除)Clin Cancer Res. 14(24):8270-8. 2008年
【要旨】
研究の目的:腫瘍細胞によって誘導される免疫抑制は、腎臓がんの治療において大きな妨げとなっている。この研究では、腎臓がん患者におけるT細胞の免疫応答の制御におけるCD33(+)骨髄由来抑制細胞(MDSC)の役割を検討した。さらに、MDSCによる免疫抑制に対するオールトランス・レチノイン酸の作用についても検討した。
実験法:CD33陽性骨髄細胞は腎臓がん患者の末梢血から分離し、T細胞の免疫応答を阻害する作用を検討した。T細胞の機能はELISPOTとCTLアッセイ法で評価した。
結果:腎臓がん患者から分離されたMDSCは、細胞障害性T細胞(CTL)と相互作用したとき、活性酸素種と一酸化窒素の産生を介して抗原特異的なT細胞応答を抑制した。しかし、健常人から採取したMDSCはT細胞応答を抑制しなかった。
MDSCによって誘導された免疫抑制とIFN-γの産生抑制は、活性酸素消去剤を投与することによって防ぐことができた。
さらに、ATRAは、MDSCを抗原提示細胞の前駆細胞に分化誘導する作用によって、MDSC誘導性の免疫抑制を阻止し、T細胞機能を改善した。
結論:これらの結果は、腎臓がんの免疫療法において、MDSCの細胞分化を誘導する方法を利用することの有用性を示唆している。
担がんマウスにオールトランス・レチノイン酸(ATRA)を投与するとMDSCは成熟した樹状細胞、好中球、単球に分化し、CTLによる免疫応答を増強できることが報告されています。
マウスの複数の実験モデルで、ATRAがワクチン治療の効果を高めることが報告されています。
移植腫瘍を使ったがんワクチンの実験でも、ATRAを投与すると腫瘍増殖の抑制効果が増強することが報告されています。
18例の腎臓がん患者にATRAを7日間投与すると、末梢血のMDSCの数が減少する結果が報告されています。
血中のATRA濃度が十分に高くなった腎臓がん患者では、MDSCの数が健常人と同じレベルまで低下しました。同時のIFN-γとIL-2のレベルの増加、Th1/Th2比(type 1 to type 2 T-helper cell ratio)の増加が認められています。
がんワクチンや抗がん剤治療との併用におけるATRAの効果に関する臨床試験が行われています。
ATRAの代わりにニキビの治療薬のイソトレチノインも同様の効果が期待できます。(
370話参照)
また、ビタミンD3も骨髄細胞の成熟を促進することが報告されています。
ビタミンD3とレチノイドは未熟な骨髄由来細胞の成熟を促進し、抗腫瘍免疫を高めることが報告されている。
例えば、頭頚部扁平上皮がん患者を対象にした臨床試験で、1日60μgのビタミンD3の投与によって骨髄細胞のHLA-DRの発現が亢進し、血中のIL-12とIFN-γの濃度が増加したという報告があります。
MDSCはマクロファージからのIL-12産生を抑制し、IL-10の産生を亢進し、Th1免疫を抑制します。
COX-2阻害剤のCelecoxibを投与すると骨髄由来抑制細胞の数が減少し、腫瘍内に浸潤するリンパ球の数が増えることが報告されています。(
446話参照)
以上のように、シメチジン、レチノイド、ビタミンD3、パルミトイルエタノールアミド、celecoxibは骨髄由来抑制細胞の働きを抑制して抗腫瘍免疫を高めることができます。(下図)