がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
326)神経膠芽腫(グリオブラストーマ)と高脂血症治療薬フェノフィブラート
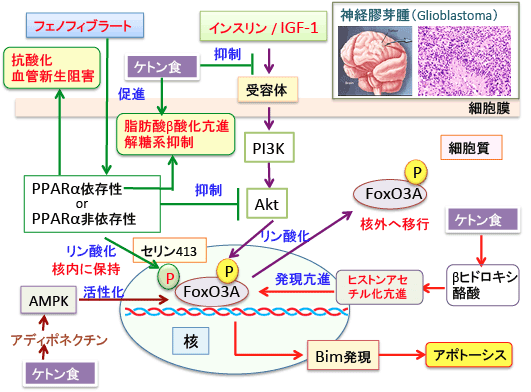
図:フィブラート系の高脂血症治療薬のフェノフィブラートが神経膠芽腫(グリオブラストーマ)に対して抗腫瘍効果を示すことが報告されている。その作用機序は多彩で、PPARα(ペルオキシソーム増殖因子活性化受容体α)の活性化を介する脂肪酸β酸化の亢進とグルコースの解糖系の抑制はがん細胞のワールブルグ効果を抑制して抗腫瘍効果を示す。さらに、PPARα依存性あるいは非依存性の機序で、PI3K/Aktシグナル伝達系の阻害や、転写因子FoxO3Aの活性化を引き起こす。FoxO3Aの活性化はアポトーシスを誘導するBimの発現を亢進し、グリオブラストーマを死滅させる。フェノフィブラートには抗炎症作用や血管新生阻害作用も報告されている。グリオブラストーマにケトン食が有効であることが報告されている。ケトン食はβヒドロキシ酪酸によるヒストンアセチル化亢進やアディポネクチン産生を介するAMP依存性プロテインキナーゼ(AMPK)の活性化によってFoxO3Aを活性化する。以上のことから、グリオブラストーマの治療にケトン食とフェノフィブラートの併用は相乗効果が期待できる。
326)神経膠芽腫(グリオブラストーマ)と高脂血症治療薬フェノフィブラート
【高脂血症治療薬(スタチン、フィブラート)のがん予防効果】
糖尿病の治療に使われるメトホルミンや、高脂血症の治療に使われるスタチンやフィブラート系の薬剤にがん予防効果がある事が報告されています。メトホルミンに関しては308話、スタチンに関しては300話と291話で解説しています。
スタチン (Statin)はコレステロールを合成する経路で働くヒドロキシメチルグルタリルCoAレダクターゼ(HMG-CoA還元酵素)の働きを阻害することによって、血液中のコレステロール値を低下させる薬物の総称です。
フィブラート(fibrate)系薬剤は、肝細胞内のペルオキシソーム増殖因子活性化受容体α(Peroxisome Proliferator Activated Receptor α:略してPPARα)という核内受容体に結合してPPARαを活性化することによって、アポA-、A-の産生増加、アポC-の産生低下、脂肪酸のβ酸化亢進、中性脂肪産生減少などの作用が発現して、コレステロールや中性脂肪を低下させる薬です。
HMG-CoA還元酵素の阻害はがん細胞の増殖シグナル伝達を阻害する作用があり、PPARαの活性化はがん細胞の増殖を抑制したりアポトーシスを誘導するタンパク質の発現を亢進する作用などがあります。したがって、スタチンやフィブラート系薬剤にはがん予防効果がある可能性が指摘され、多くの疫学研究が報告されています。(注意:スタチンとフィブラート系薬剤の併用は副作用の発症リスクが高いため、原則禁止になっています)
例えば、スタチンとフィブラート系薬剤のがん予防効果を報告している研究として以下のような論文があります。
Ten-year all-cause mortality in presumably healthy subjects on lipid-lowering drugs (from the Prospective Epidemiological Study of Myocardial Infarction [PRIME] prospective cohort).(脂質降下薬を服用中の健常者における10年間の全死因死亡率:心筋梗塞前向きコホート研究から)Am J Cardiol. 103 (3): 381-386, 2009
この論文は、50~59歳のほぼ健常と思われるフランス人7722人を10年間追跡調査した前向きコホート研究です。血清脂質(中性脂肪やコレステロール)の数値が正常な人(69.1%)、高脂血症があって治療を行っていない人(19.0%)、高脂血症があってスタチンを服用している人(4.0%)、高脂血症があってフィブラート系薬剤で治療を行っている人(7.9%)の4つのグループに分けて検討しています。
10年後に、416人が死亡(がん53.1%、心疾患17.1%、その他29.8%)しました。
高脂血症があって治療を行っていない人を1.0とした全死因死亡率のハザード比は、スタチン治療群が0.49(95%信頼区間:0.26~0.94, p = 0.031)、フィブラート治療群が0.65(95%信頼区間:0.42~0.99, p = 0.046)、脂質代謝が正常のグループは0.76(95%信頼区間:0.56~1.03, p = 0.080)でした。
高脂血症で治療を行っていない人を1.0とした場合、スタチン治療群の死因別のハザード比は、心疾患が0.55(p=0.348)、がんが0.41(p=0.067)、その他が0.68(p=0.546)でした。
フィブラート治療群の死因別のハザード比は、心疾患が0.76(p=0.499)、がんが0.52(p=0.041)、その他が0.87(p=0.746)でした。
結論として、「実生活の条件で実施されたこのコホート研究において、治療を受けていない高脂血症のグループに比較し、フィブラート系薬剤やスタチン系薬剤を服用しているグループでは、全死因死亡率が著明で低下することが示された。」「薬の服用による非心疾患による死亡のリスクの増加は認めなかった。」ということです。
このようにスタチンやフィブラート系薬剤のがん予防効果は多く報告されていますが、一方でがん予防効果を認めないというメタ解析の結果やシステマティックレヴューの論文もあります。したがって、スタチンやフィブラート系薬剤のがん予防効果や抗がん作用についてはまだコンセンサスが得られていません。
しかし、スタチンやフィブラート系薬剤をがん治療に応用しようという研究は数多く行われています。フィブラート系のフェノフィブラートの抗がん作用について興味深い論文がありますので、それを紹介します。
【フェノフィブラートはグリオブラストーマ細胞のアポトーシスを誘導する】
次のような論文があります。
Fenofibrate-induced nuclear translocation of FoxO3A triggers Bim-mediated apoptosis in glioblastoma cells in vitro.(培養したグリオブラストーマ細胞におけるフェノフィブレラートによって誘導されるFoxO3Aの核内移行はBimを介するアポトーシスを引き起こす)Cell Cycle. 11(14):2660-71.2012年
米国のルイジアナ州立大学健康科学センター(Louisiana State University Health Sciences Center)の神経腫瘍研究部門(Neurological Cancer Research)からの報告です。
【論文の要約】
カロリー制限あるいはペルオキシソーム増殖因子活性化受容体(Peroxisome Proliferator Activated Receptors:PPARs)のリガンド誘導性の活性化による抗腫瘍活性については多くの研究で示されている。しかしながら、その作用機序については十分に解明されていない。
PPARα(ペルオキシソーム増殖因子活性化受容体α)の強力なアゴニスト(受容体分子に結合して本来の伝達物質やホルモンと同様の作用を示す物質)の一つであるフェノフィブラート(fenofibrate)は、副作用の少ない抗高脂血症薬として広く使用されている。
フェノフィブラートによって活性化されるPPARα転写活性は、エネルギー代謝をグルコースの解糖系から脂肪酸のβ酸化へとシフトさせることが予想され、これは解糖系に依存性の高いグリオブラストーマ細胞のエネルギー代謝の弱点をターゲットにすることができる。
本研究では、25μMのフェノフィブラートがグリオーマ(神経膠腫)細胞やグリオブラストーマ(神経膠芽腫)細胞の増殖を効果的に抑制することが示された。この細胞増殖抑制作用は細胞周期のG1期での停止と少数のアポトーシスによる細胞死によって起こっていた。
25μMのフェノフィブラートで処理されたがん細胞は増殖を停止したままであったが、50μMの濃度でがん細胞を処理すると、72時間後に大量の細胞がアポトーシスによって死滅した。
このアポトーシスの発現に先立って、転写因子FoxP3Aのセリン413のリン酸化が起こってFoxO3Aは核に移行し、その転写活性が亢進してFoxO3Aのターゲット遺伝子であるBim の発現を亢進した。Bimの発現亢進は細胞のアポトーシスを引き起こす。この時、FoxO3Aの活性をsiRNAで阻害すると、フェノフィブラートで引き起こされるアポトーシスは阻止された。つまり、フェノフィブラートで誘導されるグリオブラストーマのアポトーシスはFoxO3Aの活性化が直接関与していることが示された。
フェノフィブラートのこのような抗腫瘍作用と、副作用の少ない薬であることから、グリオブラストーマなどの神経膠細胞の腫瘍に対する標準治療をサポートする薬の候補になるかもしれない。
グリオブラストーマ(神経膠芽腫)はヒトの悪性腫瘍の中で最も予後不良の腫瘍の一つです。手術や放射線治療や抗がん剤治療などが行われますが、このような集学的治療をおこなっても平均生存期間は12~14カ月程度であり,治療成績はここ30年以上改善がほとんどないと言われています。
この論文では、グリオブラストーマに対してフィブラート系の高脂血症治療薬のフェノフィブラートが抗腫瘍効果を示すという実験結果を報告しています。
ペルオキシソームはほぼ全ての真核細胞が持つ直径0.1-2マイクロメートルの球状の細胞小器官で、多様な物質の酸化反応を行っています。哺乳類の細胞では1個の細胞に数百から数千個が存在します。ペルオキシソームでは、脂肪酸のベータ酸化、コレステロールや胆汁酸の合成、アミノ酸やプリンの代謝などが行われています。
Peroxisome Proliferator-activated Receptor (PPAR:ペルオキシソーム増殖因子活性化受容体)は核内受容体の一種で、細胞内のペルオキシソームの増生を誘導する受容体として発見され、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群です。
フィブラート系薬剤は、このPPARに結合して、脂質代謝を改善する薬です。
PPARはペルオキシソームを増やして脂肪酸のβ酸化を亢進し、グルコースの解糖系を抑制する働きがあるので、がん細胞のワールブルグ効果(酸素がある条件でも、がん細胞はグルコースの嫌気性解糖系でエネルギーを産生していること)を阻害して、がん細胞の増殖を抑える可能性が指摘されています。この作用以外にも、インスリン様成長因子-1のシグナル伝達系(PI3K/Akt)を抑制する作用や、抗炎症作用や血管新生阻害作用などの抗腫瘍効果が報告されています。
フェノフィブラートの抗腫瘍効果には、本来のペルオキシソーム増殖因子活性化受容体(PPARα)を介した機序と、それとは関係ない機序(PPARα非依存性)が知られています。
Bimはがん細胞のミトコンドリアに作用してアポトーシスを誘導するタンパク質で、転写因子のFoxO3Aによって発現が誘導されます。フェノフィブラートはFoxO3Aを活性化してBimの発現を誘導してグリオブラストーマ細胞の増殖抑制とアポトーシス誘導を引き起こすことが、この論文で報告されています。
さて、この雑誌には、この論文に対して2つのコメントが載っています。その訳を以下に示します。
Fenofibrate triggers apoptosis of glioblastoma cells in vitro. New insights for therapy(フェノフィブラートは培養したグリオブラストーマのアポトーシスを引き起こす:治療における新しい知見)Cell Cycle. 2012 September 1; 11(17): 3154.
ペルオキシソーム増殖因子活性化受容体のアゴニスト(受容体分子に結合して本来の伝達物質やホルモンと同様の作用を示す物質)であるフェノフィブラートは、高脂血症や高コレステロール血症の治療に広く使用されているフィブラート系薬剤(中性脂肪を低下させる高脂血症治療薬の一群)の一つである。
ペルオキシソーム増殖因子活性化受容体α(Peroxisome Proliferator Activated Receptor α:PPARα)はリガンド(特定の受容体に特異的に結合する物質)誘導性の転写因子で、核内ホルモン受容体ファミリーに属し、ペルオキシソームを増殖させる作用を持つ。
興味深いことに、多くの研究結果によってPPARαのアゴニストであるフェノフィブラートが抗腫瘍活性を示し、その作用機序として、がん細胞の増殖抑制とアポトーシス誘導作用が報告されており、さらに重要なことは、全身性の毒性が非常に少ないことである。
しかしながら、フェノフィブラートの増殖抑制作用にPPARαがどのような関与をしているのか不明であるし、PPARαと関係ない機序の関与の可能性もある。
Wilkらの研究は、グリオブラストーマの培養細胞を用いて、フェノフィブラートの抗腫瘍作用に関する作用機序を検討している。
原発性脳腫瘍の約50&はグリア細胞から発生し、glioblastoma multiforme(神経膠芽腫:グリオブラストーマ)が最も多く、この神経膠芽腫はグリア細胞の腫瘍である神経膠腫(グリオーマ)の中で最も悪性度が高い腫瘍である。
現在、グリオブラストーマの治療は、手術や放射線治療や抗がん剤治療や阻害剤や抗体を使った治療などが行われており、生存期間も延びているが、多くは症状を緩和する延命治療が主体で、予後は極めて悪い。
彼らの研究において、Wilkらは、フェノフィブラートが用量と時間に依存的にグリオーマ細胞の増殖を停止させ、アポトーシスを誘導することを示している。
興味深いことに、著者らは、フェノフィブラートによってアポトーシスが引き起こされるに先立って、転写因子のFoxO3Aのセリンのリン酸化と核内への移行が起こり、さらに、アポトーシスを引き起こすタンパク質のBimが活性化したFoxO3Aによって発現が誘導された。
さらに著者らは、PPARαのその他のアゴニストはフェノフィブラートに比べて抗腫瘍効果は弱く、siRNAを使ったPPARα遺伝子のサイレンシングによるフェノフブラートの抗腫瘍効果の減弱は部分的であったので、フェノフィブラートによるFoxO3Aの転写活性とBimの発現亢進によるアポトーシス誘導には、PPARαを介した機序(PPARα-dependent)と介さない機序(PPARα-independent)の2つのメカニズムがあることが示唆された。
別の研究では、グリオブラストーマの多くの患者では、p16Ink4a-Cdk4-Rb系の細胞周期制御系の異常が起こっていることが報告されている。したがって、このp16Ink4a-Cdk4-Rbシグナル伝達系に対するフェノフィブラートの作用と、グリオブラストーマ細胞に対するアポトーシス誘導作用との関連を検討することは非常に興味深い。
全てのグリオブラストーマが同じ生物学的異常を持っているわけでは無いので、同じ治療法によってその反応や効果も患者ごとに異なる。
この観点から、細胞の増殖やアポトーシスに対するフェノフィブラートの多彩な作用を明らかにし、その作用がグリオブラストーマ細胞におけるp16Ink4a-Cdk4-Rbシグナル伝達系の異常によって影響を受けるかどうかを検討することは興味深い。
Wilkらの研究は、フェノフィブラートはグリオブラストーマ細胞にFoxO3Aの活性化を介してアポトーシスを誘導することを示しており、この研究結果は、フェノフィブラートの抗腫瘍作用を解明する最初のステップとなる。
グリオブラストーマの増殖やアポトーシスのシグナル伝達に対するフェノフィブラートの作用をさらに検討し、さらに、グリオブラストーマの現在の治療効果を改善する上でフェノフィブラートをどのように利用できるかを検討する必要がある。
The fox and the fat:An unexpected new treatment for brain tumors(転写因子foxと脂肪:脳腫瘍に対する予期せぬ新しい治療)Cell Cycle 11(18): 3353, 2012年
広く使用されている高脂血症治療薬のフェノフィブラートについて言及するとき、通常は心筋梗塞や脳梗塞を予防する効果を思い浮かべる。今週の最も予想外の発見の一つは、フェノフィブラートが致死的な脳腫瘍であるグリオブラストーマの新しい治療法である可能性が示されたことかもしれない。
神経膠芽腫(Glioblastoma multiforme)はグリア細胞(神経膠細胞)の星状膠細胞(astrocyte)の腫瘍で、脳腫瘍の全体の50%以上を占めている。グリオブラストーマは腫瘍の中でも非常に致死性の高い腫瘍として知られ、脳腫瘍の中では最も予後が悪い。いくつかの明るい進展はあるにもかかわらず、グリオブラストーマの診断後の平均生存期間は14ヶ月という悲惨な数字である。
米国では年間発生頻度は10万人当たり3人程度で、明らかに遺伝的素因や環境要因は知られていない。がん研究の強力な推進者であったエドワード・ケネディ上院議員の死因となったことで最近話題になった。
ルイジアナ州立大学のスタンレー・S・スコットがんセンター(Stanley S. Scott Cancer Center)の神経がん研究部門のKrzysztof Reiss博士とその研究グループは、グリオーマ細胞にアポトーシス(プログラム細胞死)を誘導する方法を研究している。
彼らが注目しているのはBim経路である。Bimに関しては他にも研究は行われているが、Bim によるアポトーシス誘導に関するシグナル伝達に関しては十分に明らかになっていない。
がん細胞のエネルギー代謝が解糖系から脂肪酸酸化に変わると増殖が抑制されるという作業仮説のもとに、この研究グループは、脂肪の代謝を促進することによって脂肪やコレステロールを低下させる治療薬としてスタチンとともに広く使用されているフェノフィブラートの作用を検討した。そして、彼らは、低用量のフェノフィブラートが培養したグリオブラストーマ細胞の増殖を止め、高用量のフェノフィブラートは大量の細胞死(アポトーシス)を引き起こすことを発見した。
彼らの研究は、フェノフィブラートが転写因子のFoxO3Aのリン酸化によって核内移行を引き起こしてFoxO3Aの転写活性を高め、FoxO3AはBim発現を誘導することによってグリオブラストーマ細胞のアポトーシスを誘導することを明らかにしている。
FoxO3Aとの関連はこの致死的な脳腫瘍の研究において新たな有望な手がかりを与えている。これはがんの治癒には及ばないが、ゲノフィブラートは既に臨床で使用されている薬であり、副作用が非常に少ない。現在行われている治療の補助として直ぐにでも使用できると思われる。
【フェノフィブラートとケトン食の相乗効果】
FoxO3Aのリン酸化にはリン酸化されるセリンあるいはスレオニンの部位によって、核外に移行して転写活性が阻害される場合と、逆に核内に保持されて転写活性が亢進される場合の2種類があります。
インスリン/インスリン様成長因子-1(IGF-1)はPI3K/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FoxO3Aをリン酸化します。この場合、リン酸化されたFoxO3Aは核外(細胞質)へ移行するので、FoxOの転写活性は抑制されます。
一方、フェノフィブラートはPPARαに依存性か非依存性か(どちらか、あるいは両方か)は不明ですが、Fox3Aをリン酸化しますが、この場合のリン酸化(セリン413)は、FoxO3Aを核内に保持して転写活性を高める作用があるということをこの論文は報告しています。
フェノフィブラートはPPARαの転写活性を亢進することによって脂肪酸のβ酸化を行う酵素の発現を増やし、一方、グルコースの解糖系の酵素の発現を抑制する作用があります。つまり、グルコースの解糖系の亢進に依存しているがん細胞のエネルギー代謝を阻害する効果もあります。
また、ショウジョウバエの研究で、脂肪酸のβ酸化が亢進するとFOXOが活性化して寿命が延びることが明らかになっています(318話参照)。
つまり、PPARαを刺激して脂肪酸のβ酸化を亢進するフェノフィブラートはFoxO3Aの転写活性を亢進して、ストレスに対する抵抗性を増し、がん細胞においては解糖系を抑制してエネルギー産生を低下させ、さらにアポトーシスを引き起こすBimの発現亢進などによってがん細胞を死滅させる効果が期待できるということです。
さらに、フェノフィブラートには、PPARαとは関係ない機序で、PI3K/Aktシグナル系を抑制する作用も示唆されています。
βヒドロキシ酪酸がヒストンのアセチル化を介してFoxO3Aを活性化することがマウスを使った研究で明らかになっています(322話参照)。
ケトン食がグリオブラストーマに効果があることは臨床的に示されています。また、ケトン食がてんかんを抑制する機序に一つにmTORC1の抑制があります。ケトン食がアディポネクチンの産生を増やしてAMPKの活性を高めてFoxO3Aの活性を高める作用も報告されています。
以上、様々な情報から、極めて難治性のグリオブラストーマの治療に、ケトン食、フェノフィブラート、メトホルミン(AMPKを活性化する)、イソトレチノイン(FoxO3Aの発現を亢進)の組合せは期待できるかもしれません。
PPARとレチノイドX受容体はヘテロダイマーを形成して転写因子として働きます。
フェノフブラートとレチノイド(イソトレチノイン)の併用は小児がんの治療に利用されています。また、子宮内膜がんの増殖を相乗的に増殖を抑制するという報告もあります。(In vitro and in vivo effects of the PPAR-alpha agonists fenofibrate and retinoic acid in endometrial cancer. Mol Cancer. 2006 Mar 28;5:13.)
中鎖脂肪ケトン食とフェノフィブラートとレチノイド(イソトレチノイン)とメトホルミンの組合せを自分の体で試していますが、副作用は特に問題ないようです。理論的には、脂肪酸のβ酸化が亢進し、FoxO3Aが活性化されて、健康増進や寿命延長の効果は期待できます。ただし、スタチン系薬剤とフェノフブラートの併用は副作用がでやすいので原則禁止になっていますので、他の薬を服用しているときは、薬の相互作用に注意が必要です。PPARのアゴニストとレチノイドは転写因子に作用するので、効果が高い分、副作用も注意が必要です。
アルファ・リノレン酸(亜麻仁油や紫蘇油やクルミに多い)、リノール酸、オレイン酸(オリーブオイルやアボカド)などの食事から取る長鎖不飽和脂肪酸もPPARのリガンドになります。
糖質制限+高脂肪食によるケトン食を実践するとき、抗がん作用のあるω3多価不飽和脂肪酸のDHA(ドコサヘキサンエン酸)やEPA(エイコサペンタエン酸)とケトン体を産生しやすい中鎖脂肪酸の他に、PPARを刺激するαリノレン酸やオレイン酸を多く含む食材(亜麻仁油、紫蘇油、オリーブ油、クルミ、アボカド)を多く摂取し、さらに、β酸化を亢進するL-カルニチンとフェノフィブラートを併用するとケトン食の効果を高めることができます。
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
新刊紹介:膠芽腫(グリオブラストーマ)の根治を目指す補完・代替医療
本書はプリント・オン・デマンド(Print on Demand)という出版形式で書店では販売していません。アマゾンからの購入になります。
アマゾンからの購入はこちらへ:
| « 325) 性格とス... | 327)ケトン食... » |





