がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
556)抗がん剤治療の欠陥を補完するミルクシスル(シリマリン)
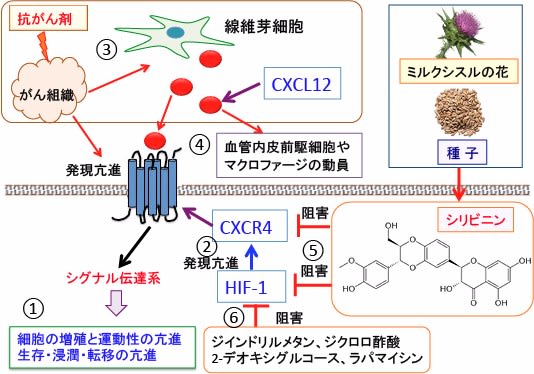
図:ケモカイン受容体CXCR4はGタンパク質に共役した7回膜貫通型の受容体で、これにケモカインCXCL12が結合することによって細胞内のシグナル伝達系が活性化されて、細胞の移動や増殖が亢進する(①)。低酸素誘導性因子-1(HIF-1)はCXCR4の発現を亢進する(②)。多くのがん細胞においてHIF-1は活性が亢進し、CXCR4が過剰に発現していて、これが転移や増殖を促進している。高用量の抗がん剤を投与してがん組織がダメージを受けると、そのダメージを修復する目的でがん組織内の線維芽細胞はCXCL12を産生し分泌する(③)。CXCL12はがん細胞のCXCR4を活性化すると同時に、CXCR4を持つ血管内皮前駆細胞やマクロファージをがん組織内に動員する(④)。ミルクシスル(マリアアザミ)の種子に含まれているシリビニンはCXCR4やHIF-1の活性化を阻害する作用がある(⑤)。CXCR4の発現は低酸素誘導因子-1(HIF-1)によって亢進するので、HIF-1の活性化を阻害するとCXCR4の発現量が減少してがん細胞の増殖や移動を抑制できる。シリビニンはCXCR4とHIF-1の活性化抑制作用を有するが、さらにHIF-1活性化を阻害するジインドリルメタン、ジクロロ酢酸、2-デオキシグルコース、ラパマイシンなどの組合せもCXCR4の発現抑制の効果が期待できる(⑥)。
556)抗がん剤治療の欠陥を補完するミルクシスル(シリマリン)
【副作用に苦しみながらの数ヶ月の延命に意味があるのか】
「固形がんに対する最大耐用量の抗がん剤投与」によるがん治療は、多くの欠陥が指摘されています。これに関しては、552話、553話、554話で解説しています。
私は大学を卒業して肝胆膵(肝臓、胆のう、膵臓)が専門の外科に入局し、最初の受け持った患者さんが膵臓がんでしたので、40年前から膵臓がんは専門にしています。
しかし、肝臓や腹膜に転移したステージ4の膵臓がんの治療成績は40年前とほとんど改善していません。進行膵臓がんに対する最大耐用量の抗がん剤治療が科学的であれば、40年も経てば、生存率や生存期間や生活の質(QOL)がもっと良くなってくるはずです。
しかし、現在でも、進行膵臓がんで通常の抗がん剤治療が始まると、ほとんどの患者さんは半年〜2年で決まったように亡くなっています。ほとんどが2年以内です。
最大耐用量の抗がん剤治療が患者さんの体力を低下させると同時に、がん細胞の薬剤耐性を誘発(促進)して抗がん剤が効かなくなり、その結果、多くの患者さんは、抗がん剤治療開始後1〜2年で抗がん剤治療を終了せざるを得なくなります。数ヶ月の延命効果はあっても、かなりの副作用で苦しみます。
例えば、ある大規模な臨床試験で、転移性膵臓がん患者のジェムザール(ゲムシタビン塩酸塩)単独投与の場合の全生存期間の中央値は6.7ヶ月、ジェムザール+アブラキサン併用群の全生存期間の中央値8.5カ月という報告があります。
ジェムザール単独群の1年生存率が22%、2年生存率は4%でした。ジェムザール+アブラキサン併用群の1年生存率は35%、2年生存率が9%でした。
(出典:Randomized phase III study of weekly nab-paclitaxel plus gemcitabine versus gemcitabine alone in patients with metastatic adenocarcinoma of the pancreas (MPACT). Journal of Clinical Oncology. 2012; 30(suppl 34): Abstract LBA148.)
膵臓がんに対するFOLFIRINOX療法(オキサリプラチン+イリノテカン+レボホリナートカルシウム+フルオロウラシル)の全生存期間の中央値は11.1ヶ月でした(ACCORD11試験)。しかし、この治療法は、末梢神経障害や下痢や高度の骨髄抑制などの副作用が高頻度に発生します。
このように、転移性膵臓がんの場合、通常の抗がん剤治療を受けてもほとんどが2年以内で亡くなるという現実があります。複数の抗がん剤を併用して抗がん作用を強くすれば、数ヶ月の延命が得られていますが、抗がん剤の数を増やせば、副作用が強くでます。
苦しみながら数ヶ月の延命という事実に、抗がん剤治療に疑問を持っている患者さんが増えています。
【固形がんに対する最大耐用量の抗がん剤治療は科学的なのか】
2017年4月に政府と国立がん研究センターが、高齢のがん患者に対する抗がん剤治療について「延命効果が少ない可能性がある」とする調査結果を発表しています。
国立がん研究センターと厚労省、経済産業省が主体となり調査を実施しています。平成19年から20年に同センター中央病院を受診したがん患者約7000人のうち、70歳以上の高齢者約1500人が対象です。がんの種類別に、抗がん剤による治療を中心に行った場合と、痛みを和らげる「緩和ケア」に重点を置いた場合とで、受診から死亡までの期間(生存期間)を比較しました。
その結果、主に肺がん・大腸がん・乳がんで末期(ステージ4)の高齢患者の場合、抗がん剤治療の有無にかかわらず、生存率は同程度であり、抗がん剤治療が明確な効果を示さない可能性があると言っています。
例えば肺がんの場合、生存期間が40カ月以上のグループは抗がん剤治療を受けなかった患者のみでした。同様に75歳以上で見た場合、10カ月以上生存した人の割合は、抗がん剤治療を受けなかった患者の方が高く、生存期間も長いという結果でした。
「抗がん剤治療が明確な効果を示さない可能性がある」と控えめな表現になっていますが、「肺がんの場合、70歳以上では生存期間が40カ月以上のグループは抗がん剤治療を受けなかった患者のみだった。75歳以上では、10カ月以上生存した人の割合は、抗がん剤治療を受けなかった患者の方が高く、生存期間も長かった。」という結果は、「70歳以上の肺がんでは、抗がん剤治療を受けると早く死ぬ」と言っているのと同じです。
長くがんの臨床をやっていると、このような結果は当たり前のようであり、気づくのが遅すぎるという印象です。
将来的に画期的な薬ができて、75歳以上でも副作用が少なく、有効性が高い治療ができれば、75歳以上でも抗がん剤治療を受けるメリットはでてきます。
問題は、現時点の抗がん剤治療は75歳以上には「メリットがない」、あるいは「死を早めている可能性がある」ということです。
現行の抗がん剤治療は、体力と回復力に依存した治療法と言えます。体力と回復力が高い若い人の場合は、副作用に耐えられる分、延命効果は得られます。副作用で苦しんでも少しでも長く生きたければ、若い人は現行の最大耐用量の抗がん剤治療は意味があります。
しかし、体力も回復力も低下している高齢者の場合は、副作用によるデメリットが、抗腫瘍効果によるメリットより大きいので、抗がん剤治療は意味が無いということです。
このように、体力や回復力の低下した人には有用性が無いという「最大耐用量の抗がん剤治療」が本当に科学的な治療か疑問になります。
【急性白血病と固形がんはがん細胞の性質がかなり異なる】
「科学は知識を生み、意見は無知を生む」というヒポクラテスの言葉があります。
「治療法が効くかどうかを判断するためには、意見ではなく科学を用いるべきだ」ということです。
ヒポクラテスは約2400年前のギリシャの医者で、原始的な医学から迷信や呪術を切り離し、科学的な医学を発展させ、その業績から「医学の父」、「医聖」とよばれています。
長い間、医学は経験に基づいて行われていました。そのような場合に、権威者の意見が幅を利かせます。しかし、意見に従っているだけでは「無知」や「停滞」を招きます。
科学的に検証することによって、正しい知識が得られ、有用な治療法を開発することができます。
進行膵臓がんに対する現行の抗がん剤治療が「科学的」というには、あまりにも進歩がなさすぎます。それは、経験から発想されたがん治療が、科学的な検証が行われずに継続されているからです。
最初の抗がん剤は、第一次世界大戦に化学兵器として使われたマスタードガスのイオウ原子を窒素に置き換えたナイトロジェンマスタードです。DNAをアルキル化することによって核酸の合成を阻害して細胞の増殖を抑えます。
その後毒性を弱めたナイトロジェンマスタード誘導体が開発され、シクロフォスファミドやメルファランといった抗がん剤が現在も使用されています。これらはアルキル化剤という抗がん剤に分類されています。
白血病や悪性リンパ腫のように初めから全身に広がる悪性腫瘍には手術による切除はできません。初めから抗がん剤治療が主体になります。抗がん剤治療は急性白血病や悪性リンパ腫の治療法として開発され、実際に急性白血病や悪性リンパ腫のような血液がんには抗がん剤は良く効きます。根治も期待できます。
血液がんで抗がん剤治療が成功したので、固形がんにも抗がん剤治療が応用されるようになりました。精巣腫瘍や小細胞性肺がんのように抗がん剤治療が著効を示す固形がんもあります。
したがって、最大耐用量の抗がん剤治療は、他の固形がんにも有効であるという前提で、多くの抗がん剤が開発され、使用されています。
しかし、多くの固形がん(肺がんや膵臓がんや胃がんや乳がんなど)に対しては、抗がん剤の効き目は極めて限定的であることが明らかになってきました。
病気の治療法には、「原因を根絶させる方法」と、「病気を悪化しないようにコントロールする方法」があります。
細菌やウイルスなどの病原菌による感染症の場合は、抗生物質や抗ウイルス剤によって病気の原因を根絶させることによって病気を治癒させることができます。局所に限局したがんであれば、手術で切除すれば、病気の原因を根絶できます。
一方、動脈硬化性疾患や神経変性疾患(認知症など)や膠原病などの慢性疾患は、病気そのものを根治させることが困難であるため、薬などによって症状が悪化しないようにコントロールする方法をとります。
動脈硬化性疾患や神経変性疾患や膠原病は慢性炎症状態が病態の基本にあります。
一方、がんは「治ることのない創傷」(Tumors are “wounds that do not heal.”)という考えがあります。固形がんは慢性炎症と同様に炎症が収束せず、永遠に創傷治癒過程(=炎症反応)が続いている状態と同じということです。
抗がん剤治療は化学療法とも呼ばれます。つまり、抗がん剤治療は感染症に対する化学療法と同じ発想で始まり、白血病など一部の悪性腫瘍では成功しました。
しかし、転移した固形がんでは、むしろ慢性疾患の治療のように、全てを治そうとするのではなく、うまくコントロールして共存していこうというアプローチの方が適しているようです。つまり、進行した固形がんは動脈硬化性疾患のように慢性疾患として対処する発想も必要かもしれません。
固形がんの抗がん剤治療は誰かの思いつきや意見で開始され継続されていて、最初から科学的でなかった可能性もあります。「最大耐用量の抗がん剤治療」という間違った道を突き進んでいるのかもしれません。
【いったん広まった医療は変えることが困難】
ナイトロジェンマスタードが最初にがん患者に使用されたのは1946年です。それ以降、現在まで、「がんはいかなるコストを払っても抹殺すべき」という考えが主流になっています。強い毒性をもった化合物を使ってがん細胞を一掃するような治療法が主流になっています。
固形がんの抗がん剤治療もその考えにしたがって、ガイドラインが作られ、標準治療としての地位を維持しています。
しかし、科学的根拠に基づいて考えれば考えるほど、転移性膵臓がんに対する現行の最大耐用量の抗がん剤治療が科学的に正しいという根拠は乏しいというのが私の結論です。
そこで、低用量の抗がん剤を使うメトロノミック・ケモテラピーや、代謝をターゲットにした治療(ケトン食、2-デオキシグルコース、ジクロロ酢酸、メトホルミンなど)、がん細胞の酸化ストレスを高める治療(ジスルフィラム、オーラノフィンなど)、がん細胞のアルカリ化を目指す治療(炭酸水素ナトリウム、プロトンポンプ阻害剤など)を併用した治療を実践しています。
しかし、このような代替療法を初めから実践する人はほとんどいません。全ての標準治療が効かなくなってから初める人がほとんどです。標準治療として認められている最大耐用量の抗がん剤治療を主治医に勧められるまま、受けています。
その理由は、標準治療の抗がん剤治療を拒否すれば、「もうここでは診ない」と言われて放り出されるからです。がん難民になるのが怖いので、ほとんどの人が標準治療を受けています。そして、2年以内に亡くなっています。
いったん広まった医療は変えるのは困難です。たとえ科学的と言えなくても、再検証することはほとんど行われていません。
そこで、欠陥だらけの標準治療を補完する「エビデンスに基づいたがん補完療法」を実践することを最近の私の診療の目標にしています。
【エビデンスに基づいた「がんの補完医療」とは】
がんの標準治療が完璧で、何の欠陥も問題も無ければ、がんの補完医療としての漢方治療もサプリメントも必要はありません。しかし、固形がんに対する最大耐用量の抗がん剤治療は欠陥だらけです。
高用量の抗がん剤投与に対する補完療法のターゲットは大きく2つに分けられます。
正常組織に対するダメージへの対応と、がん組織の悪化に対する対応の2つです。
高用量の抗がん剤投与は正常細胞にダメージを与えて、体力や免疫力を低下させます。骨髄にダメージを与えて白血球や赤血球や血小板を減少させ、消化管粘膜にダメージを与えて、吐き気や食欲低下が便通異常などの消化器症状を引き起こします。
このような高用量の抗がん剤による正常組織に対するダメージによる症状を軽減し、回復を促進することを目標にするのが補完医療が一つのターゲットです。漢方治療や栄養補助食品やサプリメントなどを使います。
第二のターゲットは、最大耐用量の抗がん剤投与ががん細胞の耐性獲得や悪化進展を促進するメカニズムです。最大耐用量の抗がん剤を投与する「最大細胞死滅戦略」には次のような複数の大きな欠陥があります。(554話参照)
① 最大耐用量の抗がん剤投与は、薬剤耐性がん細胞を増やす強い選択圧になる。
② 抗がん剤は遺伝子変異を誘発し、薬剤耐性の形質の獲得を促進する。
③ 高用量の抗がん剤治療によってがん組織がダメージを受けると、ダメージを受けた組織を修復するためにケモカインや増殖因子が産生され、これらの因子は骨髄の血管内皮前駆細胞や炎症細胞をがん組織に動員する。その結果、がん細胞の増殖が促進され、浸潤や転移が促進される。
④ 高用量の抗がん剤治療は樹状細胞やリンパ球やナチュラルキラー細胞(NK細胞)などの免疫細胞の働きを阻害する。
⑤ 競合する抗がん剤感受性細胞の集団を除去することによって、生態学における競合解放(competitive release)と同様の機序で、耐性細胞の最大限の増殖を可能にする。
このようながん細胞の悪化を促進するメカニズムを阻止する方法は、抗がん剤治療の補完医療として重要だと思います。
【ケモカインががん細胞の浸潤性や転移を促進する】
ケモカインとケモカイン受容体ががん細胞の転移や浸潤の制御で重要な働きをしています。
ケモカイン(chemokine)とは細胞遊走活性を主機能とするサイトカインの一群で、様々な細胞の移動や局在を制御に関与している低分子量(8~12 kDa)のタンパク質です。炎症性疾患や自己免疫疾患やHIV-1感染(エイズ)などの発症や病態に重要な役割を果たし、またがん細胞の増殖や転移にも関与しています。
ケモカインはよく保存された4個のシステイン残基の配置からCXC、CC、XC、CX3Cの四つのサブファミリーに分類されます。CXCおよびCX3Cケモカインでは最初と2番目のシステイン残基の間に1あるいは3個のアミノ酸残基が存在し、CCサブファミリーではそれらは連続しています。
全てのケモカインはGタンパク質共役受容体のケモカイン受容体を活性化して作用します。
現在までに、ケモカインは50種類程度、ケモカイン受容体は約20種類が見つかっており、その機能は極めて多彩で複雑です。
臓器や組織は恒常的あるいは炎症などの刺激によりケモカインを放出し、ケモカイン受容体を発現する細胞(リンパ球など)はケモカインの濃度勾配や発現部位に従って移動(遊走)します。どのリンパ球がどの臓器に移行するかは,ケモカインと受容体の種類によって厳密に制御されています。
がん細胞の転移においてはケモカイン受容体CXCR4とそのリガンド(受容体に結合して活性化する物質)のCXCL12のシグナル伝達系が重要と考えられています。
CXCL12はSDF-1(stromal cell-derived factor 1)とも呼ばれます。
ケモカイン受容体のCXCR4 が乳がん細胞に過剰に発現しており、乳がん細胞は肺より産生されるケモカインCXCL12 に導かれ、肺へ転移することが2001年にNature 誌に報告されました。(Involvement of chemokine receptors in breast cancer metastasis. Nature. 410:50–56.2001年)
つまり、乳がん細胞は単に血流に乗って偶然に肺に定着するのではなく、肺組織のケモカインCXCL12によって誘導されて肺に定着するというメカニズムです。
ケモカインのCXCL12は肺、肝臓、骨(骨髄)、脳、リンパ節に多く発現しており、これらの臓器は乳がんを含め多くのがんが転移する臓器と一致します。
つまり、乳がんを含めCXCR4を発現している多くのがん細胞は、そのリガンドであるCXCL12の豊富な環境に定着し、増殖しやすいということです。それは、ケモカインのCXCL12ががん細胞の増殖や生存を促進するからです。
がん細胞の細胞膜上のCXCR4はホモ二量体(homodimers)を形成するか、他のGタンパク質共役型受容体とヘテロ二量体を形成することによって、それぞれの受容体の活性を亢進したり抑制したりという制御を行うことが明らかになっています。
リガンドのCXCL12が結合した受容体のCXCR4がホモ二量体を形成すると、増殖シグナル系が活性化され、がん細胞の浸潤や転移が促進されます。
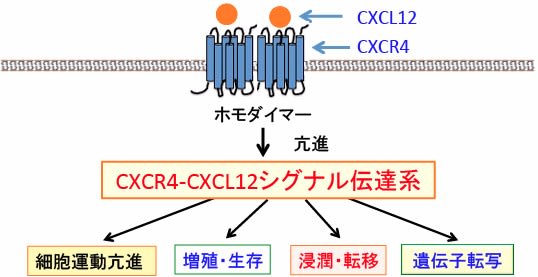
図:ケモカイン受容体のCXCR4はGタンパク質に共役した7回膜貫通型の受容体(Gタンパク質共役受容体)で、これにケモカインのCXCL12が結合することによってホモダイマー(ホモ二量体)を形成すると、細胞内のシグナル伝達系が活性化されて、細胞の移動や増殖が亢進される。
【高用量の抗がん剤はCXCR4-CXCL12シグナル伝達系を活性化する】
高用量の抗がん剤投与によってがん組織が強くダメージを受けると、がん細胞やがん組織の間質にいる線維芽細胞(がん関連線維芽細胞:cancer associated fibroblast)などからダメージを受けたがん組織を修復するため様々な炎症性サイトカインやケモカインや増殖因子などが産生されます。
このような因子によって血管内皮前駆細胞(endothelial progenitor cells)が骨髄から動員されて、血管形成が促進されて、がん細胞の増殖や転移が促進することが明らかになっています。(397話参照)
骨髄の血管内皮前駆細胞はケモカイン受容体のCXCR4を持っているので、がん組織から産生されるケモカインのCXCL12によってがん組織に動員されて血管新生が促進されるのです。(406話参照)

図:がん組織には線維芽細胞(がん関連線維芽細胞)が存在する(①)。がん関連線維芽細胞はケモカインのCXCL12を分泌する(②)。CXCL12はがん細胞に発現するケモカイン受容体CXCR4に結合することによって、がん細胞の増殖や浸潤や転移を促進する(③)。がん組織から産生されるCXCL12は骨髄から血管内皮前駆細胞(CXCR4を発現している)をがん組織に動員して腫瘍血管を増生する(④)。高用量の抗がん剤治療は組織を損傷することによってがん細胞のCXCR4の発現を高め、がん関連線維芽細胞からのCXCL12の産生を増やす(⑤)。その結果、がん細胞の増殖や浸潤や転移を促進する(⑥)。したがって、抗がん剤治療中はがん細胞のCXCR4の発現や活性を阻害すると、抗がん剤治療に伴うがん細胞の悪化を防げる。
抗がん剤投与ががん細胞の増殖能や浸潤能を高めることも指摘されています。次のような報告があります。
An undesired effect of chemotherapy: gemcitabine promotes pancreatic cancer cell invasiveness through reactive oxygen species-dependent, nuclear factor κB- and hypoxia-inducible factor 1α-mediated up-regulation of CXCR4. (抗がん剤治療の好ましくない作用:ゲムシタビンは活性酸素の産生に依存した、NF-κBと低酸素誘導因子-1の転写活性により誘導されるCXCR4の発現上昇によって膵臓がん細胞の浸潤性を亢進する)J Biol Chem. 288(29):21197-207.2013年
米国の南アラバマ大学のMitchell Cancer Institute(ミッチェルがん研究所)からの報告です。論文の概要は以下です。
抗がん剤はがん細胞にダメージを与えて死滅させることを目的にしています。しかし、抗がん剤治療によって、がん細胞がさらに悪性化したり、増殖が盛んになることがあります。
膵臓がんの治療に使われている抗がん剤のゲムシタビンに対する膵臓がん細胞の耐性のメカニズムとして、ケモカインのCXCL12とその受容体CXCR4のシグナル伝達系が重要な関与をしていることが報告されています。
この論文では、膵臓がん細胞株2つ(MiaPaCaとColo357)を使った実験で、ゲムシタビン投与が、用量依存性および時間依存性に培養膵臓がん細胞におけるCXCR4の発現を亢進する結果を報告しています。
具体的には、CXCR4の発現量は、ゲムシタビンの低用量の投与で3~4倍、高用量の投与で最大40倍の発現量の増加が認められています。膵臓がん細胞の培養液にゲムシタビン添加後1時間でmRNAが増えだし、48時間後にはmRNAは30倍、蛋白質は20倍に増加したと報告しています。
膵臓がん細胞におけるゲムシタビンによるCXCR4発現誘導は、細胞を抗酸化剤のN-アセチル-L-システインで前処理すると消失するので、活性酸素の産生に依存していることを示しています。
そして、CXCR4の発現誘導は、がん細胞におけるNF-κBとHIF-1αの蓄積と相関していました。
つまり、ゲムシタビンによって活性酸素の産生が高まって酸化ストレスが亢進すると、増殖シグナル伝達系のERK1/2とAktが活性化され、さらに転写因子のNF-κBと低酸素誘導因子-1α(HIF-1α)の活性が亢進します。このNF-κBとHIF-1αはどちらもCXCR4遺伝子の発現を促進する作用があります。
培養細胞の実験では、膵臓がん細胞をゲムシタビンで処理すると、CXCL12勾配に対する膵臓がん細胞の移動性と浸潤性が高まることが示されています。
ゲムシタビン治療によって生き延びた膵臓がん細胞は、より運動性と浸潤性が高まるということです。そして、肺や骨や肝臓などで産生されるCXCL12に導かれて転移します。つまり、標準治療で行われている高用量のゲムシタビン治療は膵臓がん細胞の増殖や浸潤や転移を促進するという好ましくない結果を生む可能性があるという報告です。以下の図にまとめています。

図:抗がん剤のゲムシタビンによってがん組織はダメージを受けると(①)、ダメージを受けた組織を修復するために、がん組織中の線維芽細胞からケモカインのCXCL12が産生される(②)。がん細胞はゲムシタビンによるダメージによって活性酸素の産生が亢進して転写因子のNF-κBや低酸素誘導性因子1α(HIF-1α)の活性が亢進し、ケモカイン受容体のCXCR4の発現を亢進し(④)、線維芽細胞から分泌されたケモカインCXCL12が結合すると増殖が亢進する(⑤)。CXCL12は骨髄の血管内皮前駆細胞や炎症細胞(マクロファージなど)をがん組織に動員する(⑥)。その結果、抗がん剤でダメージを受けたがん組織は血管の新生・増生や炎症性サイトカインの産生、酸化ストレスの亢進が起こる(⑦)。その結果、がん細胞の増殖が促進され、浸潤や転移が促進される(⑧)。
幾つかの抗がん剤はがん細胞の酸化ストレスを高めてがん細胞を死滅させます。がん細胞を死滅させるだけの十分な酸化ストレスが与えられれば、がん治療に有効ですが、完全に死滅できなければ、逆にがん細胞を悪化させることになるということです。
このように、通常の高用量の抗がん剤投与を行うと、血管の増生やがん細胞の浸潤性や転移性が亢進することになり、そのメカニズムとしてケモカインCXCL12とその受容体CXCR4の関与が存在するということです。
CXCL12はStrtomal derived factor 1(間質由来因子1)とも呼ばれ、本来は炎症などにおいてリンパ球や造血幹細胞の移動に関与しています。
がん関連線維芽細胞はCXCL12のようなケモカインだけでなく、HGF(Hepatocyte Growth Factor)などの様々な増殖因子や活性酸素を産生することによってがん細胞の増殖や浸潤を促進しています。
そして、抗がん剤治療によって強いダメージを受けると、損傷を受けたがん組織のダメージを修復する目的でケモカインや増殖因子を産生して血管内皮前駆細胞やマクロファージを動員し、その結果、がん細胞の増殖や浸潤は促進され、がんはさらに悪化するという経過を辿ることになります。
これが、高用量の抗がん剤治療がうまくいかない理由の一つです。
抗がん剤治療のターゲットはがん細胞だけでなく、間質の細胞(線維芽細胞やマクロファージなど)とがん細胞の相互作用についても十分に考慮することが重要です。
【CXCR4を阻害するミルクシスル(マリアアザミ)のシリマリン】
CXCR4/CXCL12のシグナル伝達系を阻害する方法は、抗がん剤治療中のがんの悪化(転移や浸潤の促進)を防ぐ効果が期待できます。
ミルクシスル(マリアアザミ)の種子の薬効成分であるシリマリン(多種類のフラボノリグナン類の総称)がCXCR4/CXCL12のシグナル伝達系を阻害することが報告されています。以下のような報告があります。
Silibinin, a novel chemokine receptor type 4 antagonist, inhibits chemokine ligand 12-induced migration in breast cancer cells.(新規のケモカイン受容体タイプ4拮抗薬のシビリニンは乳がん細胞のケモカインリガンド-12によって誘導される移動を阻害する)Phytomedicine. 21(11):1310-7. 2014年
【要旨】
研究の目的:C-X-Cケモカイン受容体タイプ4(CXCR4)はがん細胞の浸潤や移動に関与していることが明らかになっている。したがって、CXCR4の働きを阻害する受容体拮抗剤(アンタゴニスト)はがん細胞の転移する抗がん作用が期待できる。この研究は、天然成分の中からがん細胞の転移を減少あるいは阻止するCXCR4拮抗薬を見つける目的で行った。
方法と結果:コンピュータを使った分子構造の解析のスクリーニングによってシリビニンが新規のCXCR4拮抗薬であることを報告する。生化学的解析によって、シリビニンがCXCR4と競合的に結合することによってケモカインリガンド12(CXCL12)によって生じるCXCR4の活性化を阻害し、CXCR4の下流のシグナル伝達系の活性化を阻害することが示された。
CXCR4を過剰に発現しているヒト乳がん細胞のMDA-MB-231細胞において、シリビニンを投与することによってCXCL12で誘導されるがん細胞の移動が阻害された。CXCL12を過剰発現している乳がん細胞はシリビニンによる増殖抑制作用が顕著に認められた。シリビニンによる増殖抑制効果はCXCR4を多く発現しているがん細胞で強く認められた。
結論:シリビニンはCXCR4拮抗薬であり、がん細胞の転移を予防する効果を持っている。
シリビニン(silibinin)はシリマリン(ミルクシスルに含まれるフラボノリグナン類の総称)の主成分です。高用量の抗がん剤治療によるがんの悪化を防ぐ目的で、シリビニンを多く含むミルクシスルのサプリメントを摂取することは有用だと言えます。
【シリビニンはがん性悪液質を阻止する】
膵臓がん患者の83%ががん性悪液質の状態になり、膵臓がん関連の死亡の主要な原因となっていると報告されています。がん性悪液質では、脂肪だけでなく筋肉も減少します。膵臓がんの治療では、がん細胞の増殖と悪液質の進展を阻止する有効な治療手段が必要です。
ミルクシスルのシリビニンが膵臓がんの代謝を正常化して悪液質を改善する作用が報告されています。
Silibinin-mediated metabolic reprogramming attenuates pancreatic cancer-induced cachexia and tumor growth(シリビニンによる代謝の再プログラム化は膵臓がんの悪液質とがん細胞増殖を低減する)Oncotarget. 2015 Dec 1; 6(38): 41146–41161.
シリビニン(silibinin)はミルクシスル(マリアアザミ)というキク科の植物の種子に含まれるシリマリンの一種です。シリマリンはミルクシスルに含まれるフラボノリグナン(flavonolignan)の総称です。シリビニンは最も抗腫瘍活性の高いシリマリンです。
シリマリンは低酸素誘導性因子-1(HIF-1)活性の阻害や、解糖系の阻害など複数の作用メカニズムでがん細胞のワールブルグ効果を是正(正常化)する作用があります。(267話、270話参照)
この論文では、膵臓がん細胞を使った動物実験で、シリビニンが膵臓がん細胞の解糖系を阻害し、代謝系の再プログラム化(正常化)によって、がん細胞の増殖を抑え、体重や筋肉の減少(=がん性悪液質)を阻止することを報告しています。
シリビニンはSTAT3を阻害し、がん遺伝子のc-Mycの発現を減少させます。
シリビニンはIL-6やIL-8のような炎症性サイトカインの発現を阻害して抗炎症作用を示します。
さらに、シリビニンは低酸素誘導性因子-1α(HIF-1α)の活性化を抑制し、mTOR経路の活性を阻害します。
CXCR4は低酸素誘導因子-1(HIF-1)によって発現が誘導されます。したがって、HIF-1の活性を抑制する方法はCXCR4の発現を阻害して抗腫瘍効果を発揮することになります。HIF-1の阻害については364話で解説しています。
シリマリンはHIF-1活性を阻害する作用があります。その他、ジインドリルメタン、ジクロロ酢酸ナトリウム、2-デオキシグルコース、ラパマイシンなどがHIF-1の発現や活性を阻害します。したがって、これらの組合せはCXCR4-CXCL12シグナル伝達系の抑制にも効果が期待できます。(トップの図)
【ミルクシスルとシリマリンとは】
ミルクシスルは学名をSilybum marianum と言い、マリアアザミ、オオアザミ、オオヒレアザミなどと呼ばれます。原産は地中海沿岸で、ヨーロッパ全土、北アフリカ、アジアに分布しています。日本においても帰化植物として分布しています。
葉に白いまだら模様があるのが特徴で、この模様はミルクがこぼれたようにみえるためmilk thistle(thistleはアザミの意味)と言い、ミルクを聖母マリアに由来するものとしてマリアアザミの名があります。
このミルクシスルの種子には、シリビニン(silibinin), シリジアニン(silydianin), イソシリビン(isosilybin), シリクリスチン(silychristin)などのフラボノリグナン(flavonolignan)が含まれています。ミルクシスル種子に含まれるフラボノリグナンを総称してシリマリン(silymarin)と呼ばれています。このシリマリンの主成分(含有量は50~60%程度)がシリビニンです。
つまり、ミルクシスルの種子の薬効成分はシリマリン(多種類のフラボノリグナン類の総称)であり、シリマリンの主成分がシリビニンということです(下図)。

図:ミルクシスルの葉の縁は尖った波形で、葉脈に沿って白い縞模様がある。この模様がミルクがこぼれたように見えるため、ミルクシスル(シスルはアザミのこと)と言い、ミルクを聖母マリアに由来するものとしてマリアアザミの名前がついている。種子が薬用として利用され、その薬効成分はシリマリンと呼ばれるフラボノリグナン類で、シリマリンの主成分がシリビニンで、シリビニンは最も生物活性の高いシリマリンと考えられている。
【シリマリンは肝臓障害を軽減する】
ヨーロッパでは2000年以上前から民間薬として肝機能障害などの治療に経験的に利用されています。ミルクシスル種子は4~6%のシリマリンを含有しており、このシリマリンがミルクシスルの肝機能改善作用の効果の活性成分で、1970年代からシリマリンを中心に研究がすすめられ、ミルクシスルおよびその活性成分のシリマリンの肝細胞保護作用や肝機能改善作用の効果が科学的に証明されています。
ウイルス性肝炎やアルコール性肝炎あるいは肝硬変の患者を対象にした複数の臨床試験でシリマリンの肝機能改善効果や延命効果が確かめられています。
シリマリンは最も強力な肝臓保護物質の一つとして知られています。シリマリンのもつ肝臓保護作用は、肝臓の蛋白質合成を刺激する作用とともに、肝障害の原因となるフリーラジカルやロイコトリエンやプロスタグランジンを抑制することに起因します。
シリマリンにはビタミンEより強い抗酸化作用があります。
肝臓のグルタチオンの量を増やす効果も指摘されています。グルタチオンは肝臓の解毒能や抗酸化作用を高めます。
【シリマリンは抗がん剤の副作用を軽減する】
アルコールや医薬品、トルエンやキシレンなどの化学薬品、毒キノコなど多くの肝臓毒性物質による肝臓傷害に対してミルクシスルが肝臓保護作用を示すことは、動物実験のみならずヒトでの臨床試験でも確認されています。
例えば、死亡率30%に上る毒キノコであるタマゴテングタケを摂取する前にミルクシスルの活性成分であるシリマリンを服用すると、100%の確率で中毒を防ぐことができ、毒キノコ服用後24時間後でも死亡を防ぐ効果があることが報告されています。
また、有毒なトルエンやキシレン蒸気に5~20年間曝露された労働者の肝障害に対して、シリマリン投与によって有意な改善がみられることが報告されています。
アルコール性肝障害に対しても、ミルクシスルおよびその活性成分のシリマリンは非常に高い改善効果が認められています。動物実験では、四塩化炭素、ガラクトサミン、エタノールなど様々な有害な化学薬品による実験的肝障害の全てに対して、ミルクシスルは肝臓保護作用を示すことが確かめられています。
抗がん剤の多くは肝臓で代謝され、肝臓にダメージを与えます。このような抗がん剤治療による肝臓障害に対しても、ミルクシスルの有効性が報告されています。
欧米では、抗がん剤治療を受けている患者さんが、自分の判断あるいは医師の処方としてミルクシスルのサプリメントを摂取しています。欧米では、ミルクシスルの肝臓保護作用が良く知られており、サプリメントとして多くの商品が販売されています。肝障害を予防できると、抗がん剤治療を予定通り行うことができます。
肝機能障害を発症した急性リンパ性白血病の50人の子供を対象に、ミルクシスルのサプリメントの治療効果がランダム化二重盲検試験で検討されています。その試験結果によると、ミルクシスルの投与によって、肝機能が著明に改善し、副作用によって抗がん剤を減らす必要があった症例の率が低下し、抗がん剤の効き目には差はなかった(抗がん剤の効き目を妨げない)ことが報告されています。
ミルクシスルは肝臓保護作用の他にも、抗がん剤による腎臓や心臓のダメージを軽減する効果も報告されています。放射線による腎臓のダメージにもミルクシスルは保護作用を示します。
ラットを使った実験で、ドキソルビシンの心臓毒性と肝臓毒性に対して保護作用を示すことが報告されています。
全身麻酔による副作用や合併症を予防するために、手術前にミルクシスルの服用を推奨する意見があります。シリマリン(420mg/日)の投与によって全身麻酔による肝障害が予防できることが臨床試験で示されています。
シリマリンは肝細胞の蛋白質合成能を高め、ダメージを受けた肝細胞の修復や再生を促進します。しかし、肝臓がん細胞に対しては増殖や蛋白合成を刺激する効果は無いと言われていますので、肝臓がんにも使用できます。
ミルクシスルとアルファリポ酸とセレニウム(セレン)の組み合わせがウイルス性慢性肝炎に効果があるという報告があります。抗がん剤の肝障害にもこの組み合わせは効果が期待できます。
ラットを使った実験ではγ線照射の1時間前にシリマリンを投与すると脾臓や肝臓や骨髄のダメージが緩和することが報告されています。脳転移の患者に放射線治療を行うときにオメガ3不飽和脂肪酸とシリマリンを服用すると、副作用が軽減し生存期間が延びることが臨床試験で示されています。
培養細胞や動物実験では、ミルクシスルは抗がん剤の効き目を高める可能性が示唆されています。
【シリマリンは解毒機能を高める】
「血液浄化」や「解毒」という用語は、体に取り込まれた毒物を解毒し、体内にたまった老廃物の排泄を促進して、血液をきれいにする作用を意味します。
抗がん剤による治療中や治療後では、死滅したがん細胞や正常細胞によって死細胞や老廃物が蓄積します。また、抗がん剤が完全に代謝されて排泄されるまでは抗がん剤の毒作用がしばらく残ります。
このような体内に増えた毒性物質や老廃物の分解と排泄を促進し、血液をきれいな状態にするために、「血液浄化(cleansing)」や「解毒(detoxification)」を促進する薬草治療の有用性が検討されています。
抗がん剤治療中および治療後の血液浄化と解毒作用に関して、ミルクシスルの有効性が報告されています。
毒物を解毒し血液を浄化する主な臓器は肝臓と腎臓ですが、ミルクシスルは肝臓の解毒機能を高めることが知られています。
ミルクシスルはヨーロッパでは古くから肝臓の治療薬として用いられ、抗がん剤治療によって受けたダメージの回復や血液浄化にも有効であることが多くの臨床試験によって確認されています。
抗がん剤による肝臓のダメージを軽減し、傷害を受けた肝細胞の再生を促進する作用も確かめられており、西洋医学でも血液浄化と解毒を促進するハーブとして利用されています。
【シリマリンには直接的な抗腫瘍活性がある】
シリマリンには、グルコーストランスポーターの活性阻害、低酸素誘導因子−1(HIF-1)の活性阻害、mTOR/p70S6K/4E-BP1シグナル伝達系の阻害などによってがん細胞のエネルギー産生を阻害し、さらに、細胞周期の制御、アポトーシス誘導、血管新生阻害、浸潤や転移の阻害、抗酸化作用や抗炎症作用、抗がん剤や放射線治療の副作用軽減など、極めて多彩な抗腫瘍効果が報告されています。
様々な動物発がん実験において、シリマリンががん予防効果を発揮することが報告されています。肝臓がんや大腸がんや腎臓がんなどのがん細胞を移植した動物実験で、シリマリンが腫瘍の縮小効果を示すことが報告されています。
切除不能の進行した肝臓がんが、1日450mgのシリマリンを服用してがんが自然退縮したという症例の報告があります。(Am J Gastroenterol. 90:1500-1503, 1995)
手術と放射線治療を行った前立腺がん患者において、シリマリン、大豆、リコピン、抗酸化剤の入ったサプリメントを服用することによって再発が有意に抑えられることが報告されています。(Eur Urol. 48: 922-930, 2005)
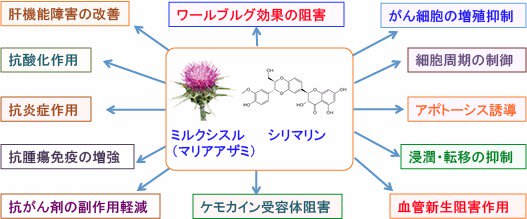
図:ミルクシスルの種子に含まれるシリマリンは様々なメカニズムで抗がん作用を示す。
以上のように、シリマリン自体は毒性が極めて低く、抗酸化作用や肝細胞保護作用など抗がん剤治療による副作用を軽減する効果も多くの臨床試験などで確認されています。さらにがん細胞のワールブルグ効果を是正する作用や、増殖シグナル伝達系を抑制する作用があるため、がん治療において併用するメリットが高い成分と言えます。
【シリマリンの服用法】
サプリメントとして商品化されているものは、70-80%のシリマリンを含有するように調整されており、臨床試験の多くはこのようなスタンダードな製品を用いています。
臨床試験では、シリマリンを1日に140mgを3回(420 mg/日)の用量で行われています。
ミルクシスル種子を熱湯で煎じて服用する方法は古くから使用されています。
煎じ薬の場合は、1日3~9g程度の潰した種子を煎じ、これを1日数回に分けて服用します。
ミルクシスル種子は4~6%のシリマリンを含有しますので、9gの種子にはシリマリンが360~540mg含まれている計算になります。
ミルクシスルやその成分のシリマリンにはほとんど副作用が無いことが多くの臨床試験で示されています。副作用としては、便が軟らかくなることが稀にあるくらいです。胆汁の分泌が多くなって軟便や下痢の原因になるからです。
ドイツのCommissin Eによると、通常の量を摂取した場合にはミルクシスルによる副作用は報告されていません。米国ハーブ教会の分類では、適切に使用される場合、安全に摂取できるハーブに分類されています。長期投与でも全く毒性は認められていません。
イリノテカンを投与中の大腸がん患者に1日200mgのミルクシスルを投与し、イリノテカンの代謝になんら悪影響を及ぼさなかったと報告しています。
今までの臨床研究から、1日5gまでのミルクシスルの摂取はほとんど副作用が現れないと言えます。ミルクシスルは肝細胞の再生を促進する作用があるため、肝細胞ががん化した肝細胞がんに対しては、ミルクシスルを使用しない方が良いという意見があります。しかし、肝臓がん細胞の増殖を促進する効果は無いという反対意見や、ミルクシスルの服用によって肝臓がんが縮小した症例もあります。
高用量のシリビニンが乳がんの増殖を促進することを示した動物実験の結果が報告されていますので、投与するシリビニンの量や利用効率を高めることに対して疑問の声も上がっています。しかし、この動物実験で使用された用量は人間では達成できないほどの高用量であるので問題ないという反対意見もあります。
ヨーロッパでは、肝臓障害に対してミルクシスル単独での治療が行われていますが、漢方薬でも肝臓障害に有効な生薬は幾つも知られています。このような肝障害に有効な生薬を使った漢方薬にシリマリンのサプリメントを併用すると、抗がん剤による肝臓のダメージをさらに緩和することができます。
私のクリニックでも、抗がん剤の副作用軽減と抗腫瘍効果増強にミルクシスル(シリマリン)のサプリメントと漢方薬の組合せは多く使っています。
◎ ミルクシスルのサプリメントについてはこちらへ:
| « 555)トリプル... | 557)アセチル-... » |



